
Fig.1
Rápidamente se produce un precipitado rojo anaranjado de (NH4)2HgI4, que se extiende a las dos gotas (fig.2-8).
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
PRECIPITACIÓN DE SALES DE Hg2+
9. Yodomercuriatos (1)
Cloruro de
mercurio(II) y yoduro potásico+hidróxido amónico
Partimos de una gota de cloruro de mercurio y otra yoduro potásico disuelto en hidróxido amónico (fig.1)

Fig.1
Rápidamente se produce un precipitado rojo anaranjado de (NH4)2HgI4, que se extiende a las dos gotas (fig.2-8).

Fig.7

Fig.6
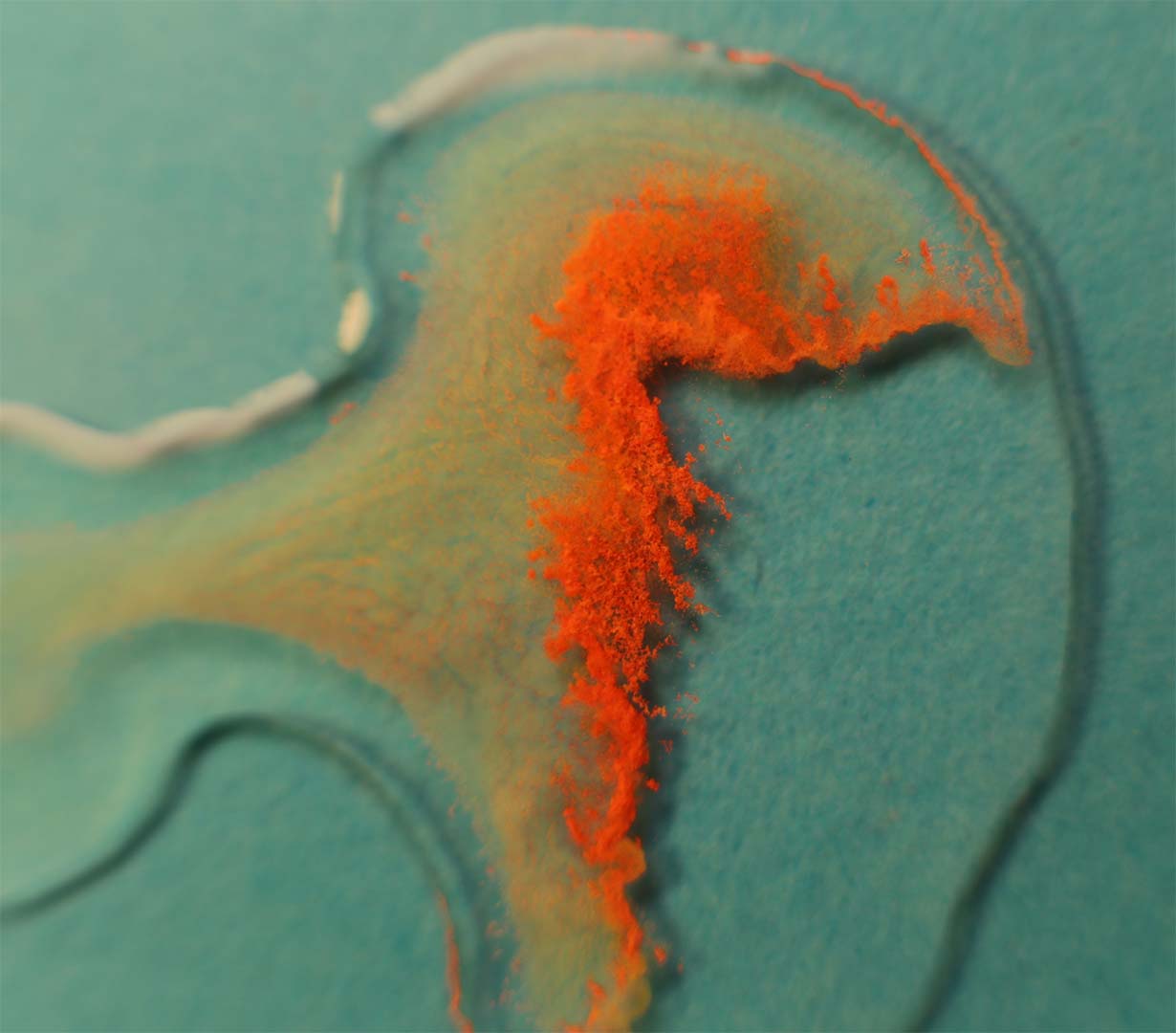
Fig.5

Fig.3

Fig.2
Se le agrega una gota de BaCl2 produciéndose un nuevo precipitado cristalino, esta vez blanco (fig.9- 11).

Fig.8 (Se le agrega una gota de cloruro de bario)
(NH4)2HgI4(s)+BaCl2 (ac)=
produciéndose un precipitado blanquecino

Fig.10 (Detalle)
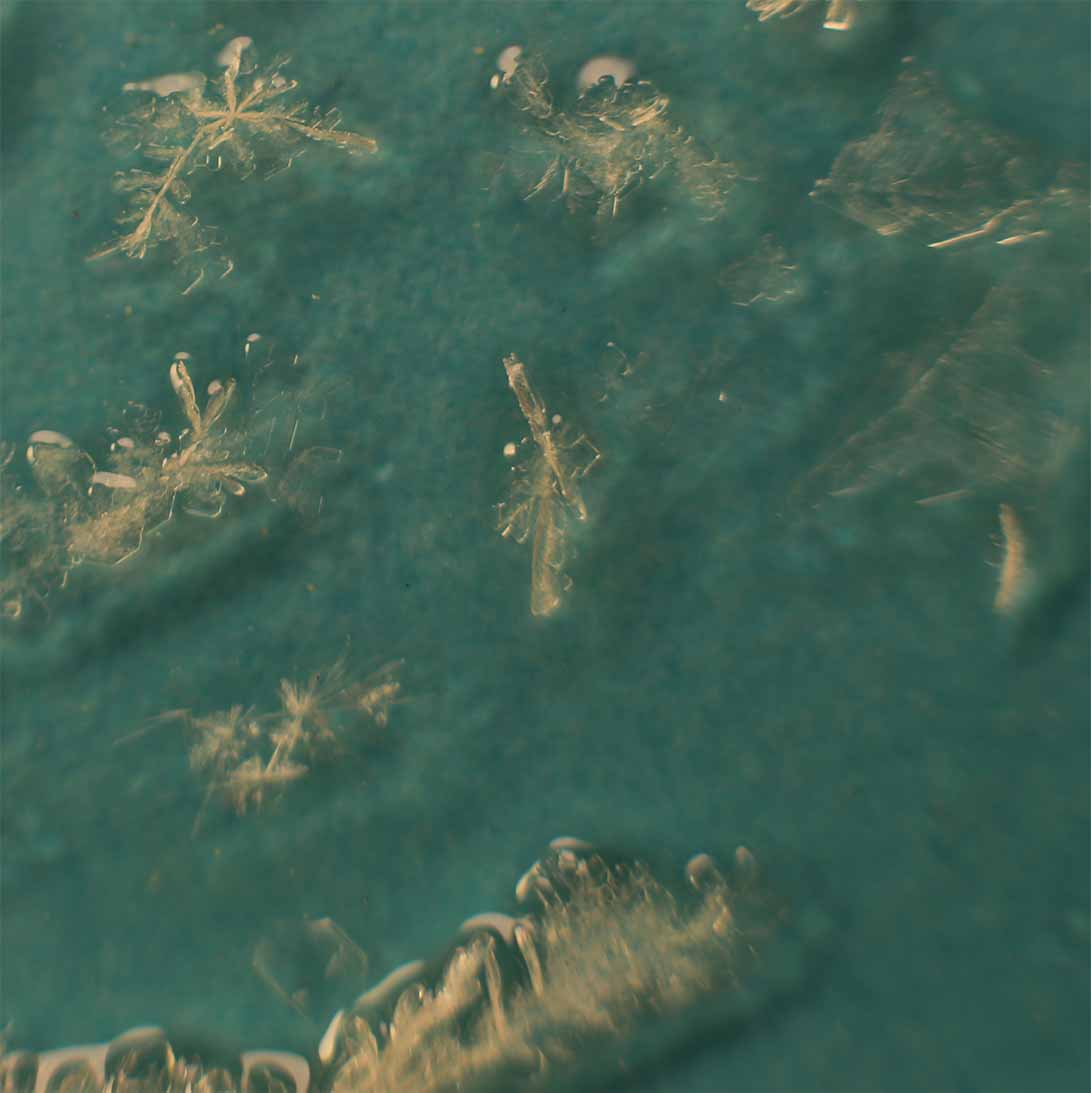
Fig.9
El proceso que tiene lugar es:
4KI
(ac+2NH4OH)+ HgCl2 (ac)= (NH4)2HgI4(s)+2KCl(ac)+H2O+K2O
Precipitado blanco anaranjado

Fig.4

Fig.11