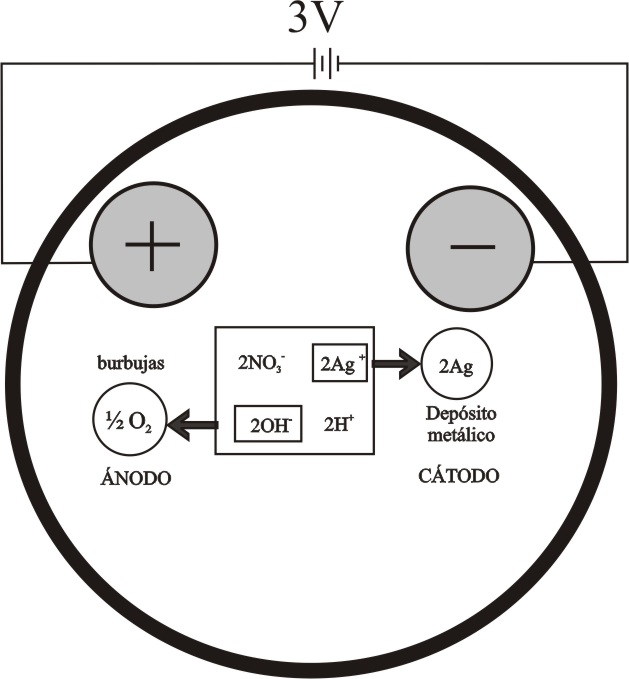
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
LA ELECTRÓLISIS DE DISOLUCIONES SALINAS
(V)
Se va a presentar la electrólisis de sales de elementos
pesados con diferentes aniones a fin de observar la electrodeposición de estos
metales, si la hubiere. Las sales sometidas a electrólisis son: nitrato de plata,
cloruro de estaño y nitrato de plomo. Observándose el diferente comportamiento de estos dos últimos
metales que habitualmente se consideran con propiedades
parecidas.
Se emplea un montaje
con electrodos metálicos siendo en el caso del nitrato de plomo, el cátodo circular.
ELECTRÓLISIS DEL NITRATO DE PLATA
La electrólisis del nitrato de plata, sal bastante soluble
en agua, en una disolución bastante concentrada (0,5M) se produce a través
de los fenómenos descritos en el dibujo (fig.1), de acuerdo con la facilidad de descarga de los iones en los
electrodos respectivos dada en la figura 2 de primera parte de este trabajo. Se emplean en
principio electrodos metálicos.
En el ánodo se descargará el OH-, y en el
cátodo el Ag+
Ánodo : 2OH- -2e = ½ O2 (gas)
+ H2O
Cátodo: 2Ag+ + 2e = Ag(s)
quedando en disolución
ácido nítrico, que atacará al electrodo metálico y producirá un pH ácido.

Fig.1
Las fotografías que describen este proceso, son las figuras
2, 3, 4 y 5 .
La 6, corresponde a un detalle del cátodo.

Fig.2
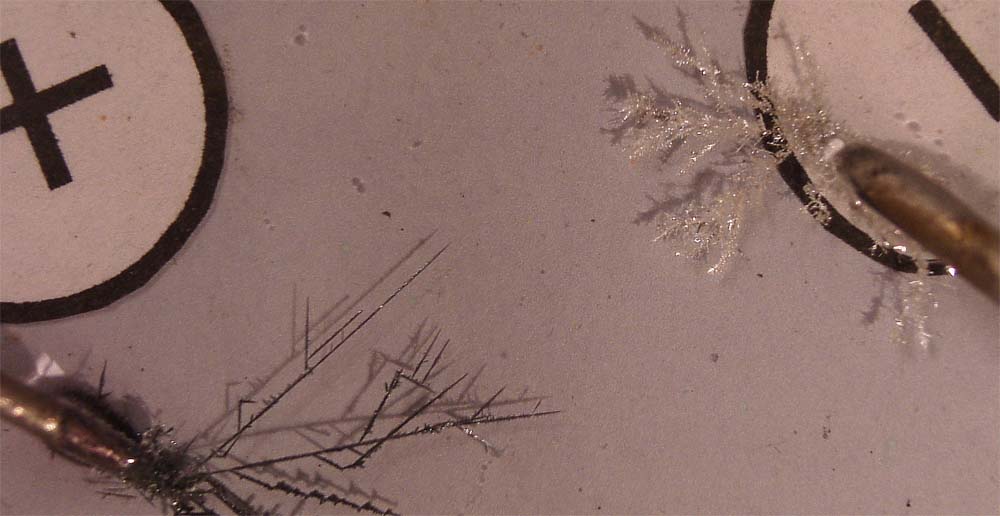
Fig.3

Fig.4

Fig.5

Fig.6 ( Detalle de la zona del cátodo)
No se observa perfectamente el desprendi-miento de oxígeno
en forma de burbujas, en el ánodo, mientras que se deposita plata metálica
en el cátodo. Ello se debe posiblemente a la rápida reacción con la plata
en disolución formándose óxido de plata negro, que crece rápidamente hacia
el electrodo negativo.
Las fotografías de las figuras 2 a 4 se han tomado en un intervalo de tiempo de 10
minutos, con una diferencia de potencial de 3V.
En la figura 6 se aprecia el detalle del
árbol de plata que se forma (árbol de diana). Esta denominación, conocida
desde finales del siglo XVI, fue propuesta por el alquimista italiano Juan
Bautista Porta.
Si se emplean electrodos de grafito ocurre
lo mismo, observándose mejor el despren-dimiento de oxígeno. Véase en la figura
7, con electrodos de grafito, las burbujas de oxígeno pegadas al ánodo, especialmente
en el detalle de la fig.8.
Si la concentración del nitrato de plata es inferior la apariencia de la electrodeposición de la plata metálica es muy diferente a la dada.
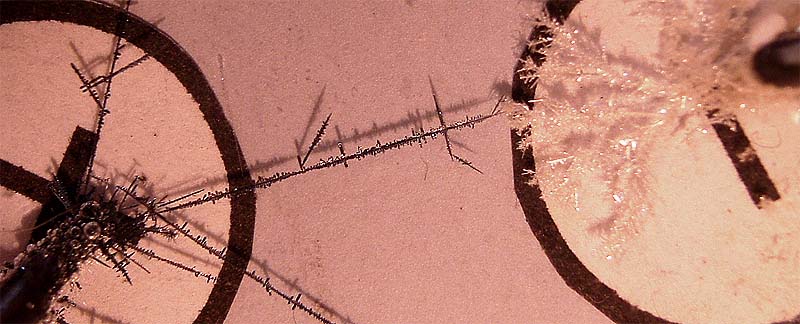
Fig.7

Fig.8
ELECTRÓLISIS
DEL CLORURO DE ESTAÑO (II)
En la figura 9, se presenta un esquema de
lo que sucede en las proximidades de los electrodos, de acuerdo con lo explicado
en desarrollos anteriores.
Ánodo :
2Cl- -2e = Cl2 (gas)
Cátodo: Sn 2+ + 2e = Sn(s)
La disolución debería tener un pH neutro.
Sin embargo como demuestran las fotografías lo que ocurre
es bien diferente y lo que se desprende en el cátodo en hidrógeno gas:
Ánodo :
2Cl- -2e = Cl2 (gas)
Cátodo: 2H
+ + 2e = H2 (gas)
Sólo al cabo de cierto tiempo se aprecia la aparición del Sn(s) oscuro.
Por lo que parece lógico que el proceso
prioritario surja según el esquema de la fig 10, con lo que el pH final será
algo básico.
Las fotos digitales sucesivas, se dan en
las figuras 11 y12,
En la fig. 13, se aprecia el detalle de la zona anódica
donde se aprecia el desprendimiento en forma de burbujas de cloro
En la fig.14. se observa el detalle de la zona catódica
donde se aprecia el desprendimiento en forma de burbujas de hidrógeno y la
posible aparición final del estaño.
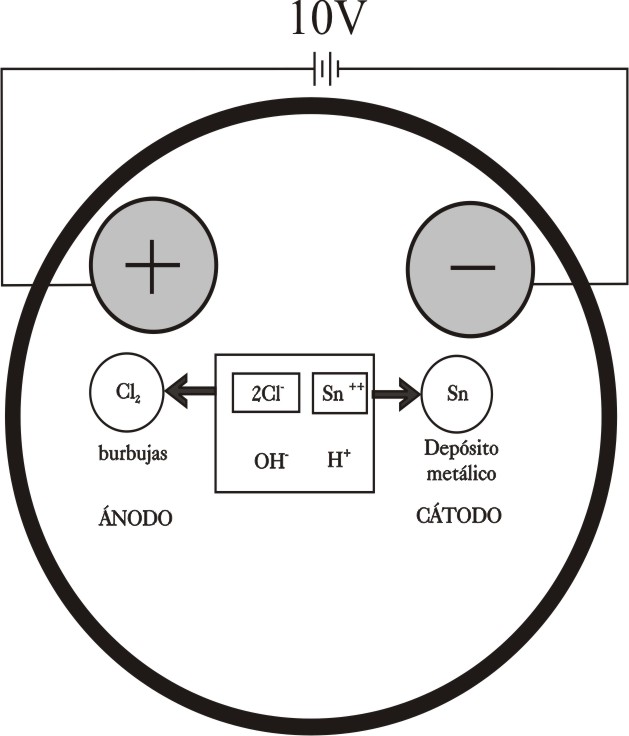
Fig.9
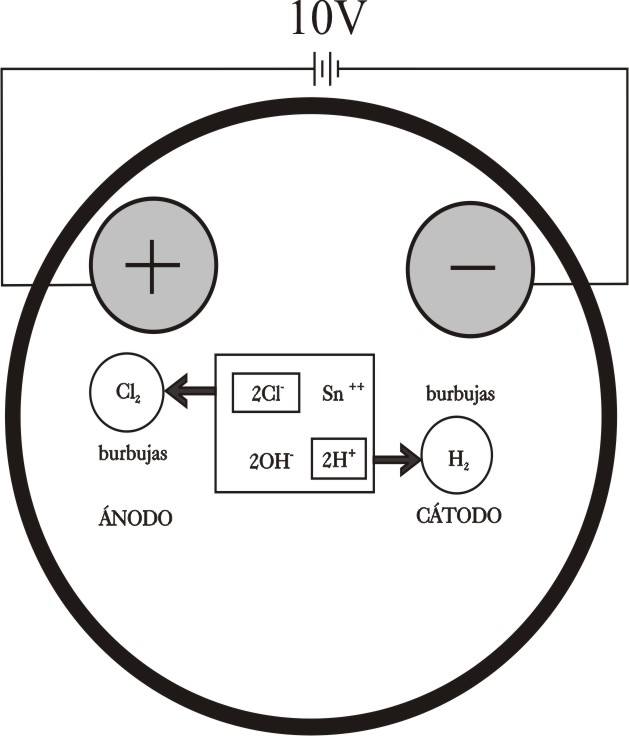
Fig.10
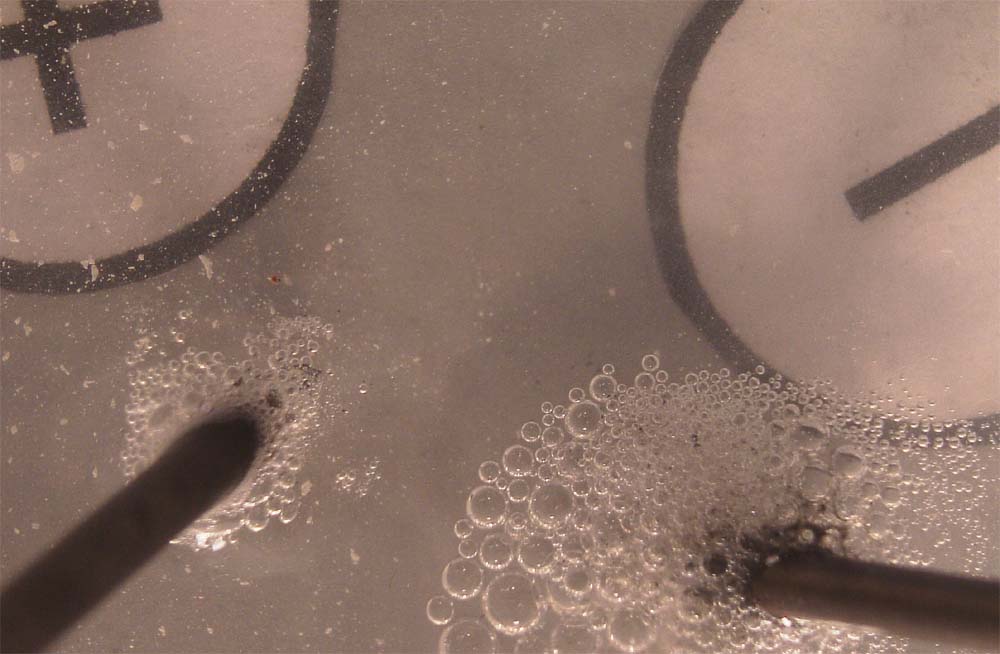
Fig.11

Fig.12
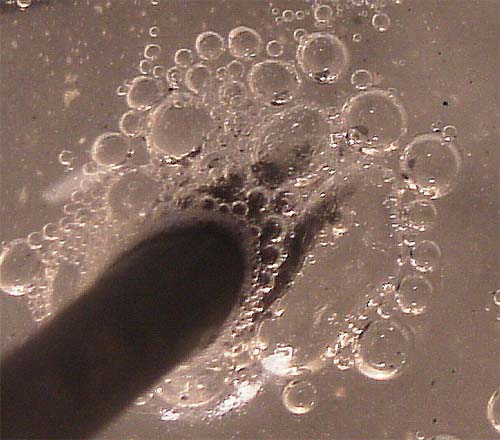
Fig.13 ( Detalle del ánodo)

Fig.14 (Detalle del cátodo)
ELECTRÓLISIS DEL NITRATO DE PLOMO(II)
La electrólisis del nitrato de plomo, produce un depósito metálico de plomo , muy diferente a lo que ocurría en el casos anteriores
En el ánodo se descargará el OH-, y en el
cátodo el Pb2+.
Los procesos esquematizados en la figura 15, serían:
Ánodo : 2OH- -2e = ½ O2 (gas)
+ H2O
Cátodo: Pb2+ + 2e = Pb(s)
quedando en disolución
ácido nítrico que producirá
Las fotografías que describen este proceso son las figuras
16, 17 y18 sucesivamente. La figura
19, corrresponde a un detalle del cátodo
2.jpg)
Fig.15
Fig.16

Fig.17

Fig.18

Fig.19