Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
ELECTRÓLISIS DE DISOLUCIONES SALINAS (III)
Se va a presentar la electrólisis de sales de elementos
del mismo grupo (el 12), con diferentes aniones a fin de observar la electrodeposición
de estos metales. Las sales sometidas a electrólisis son: sulfato de cinc,
nitrato de cadmio y cloruro de mercurio(II).
Se emplea un montaje
con electrodos metálicos siendo el cátodo circular.
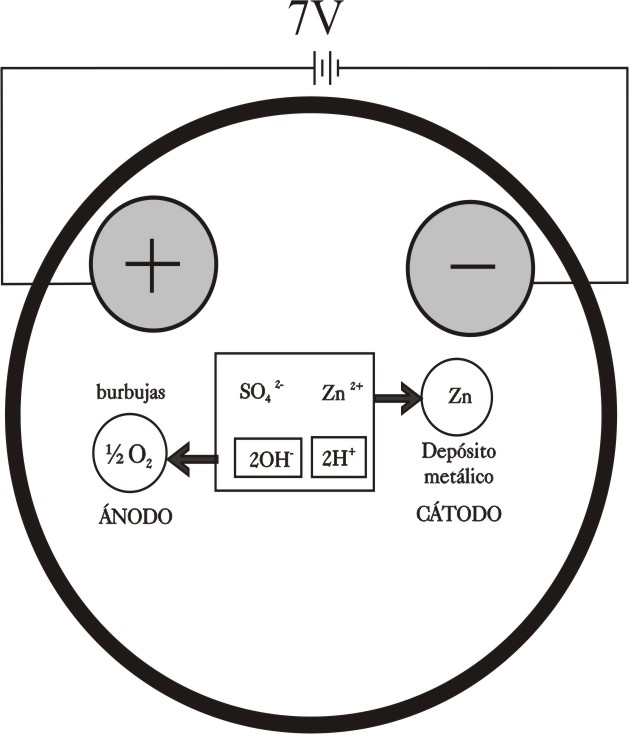
ELECTRÓLISIS DEL SULFATO DE CINC(II)
La electrólisis del sulfato de cinc, sal bastante soluble
en agua, se produce a través de los fenómenos descritos en el dibujo, de acuerdo
con la facilidad de descarga de los
iones en los electrodos respectivos dada en la figura 2 de primera parte de este trabajo. Se emplean electrodos
metálicos, que en caso del cátodo terminará en una circunferencia que enmarca
el signo del terminal.
En el ánodo se descargará el OH-, y en el
cátodo el Zn2+
Ánodo : 2OH- -2e = ½ O2 (g)
+ H2O
Cátodo: Zn2+ + 2e = Zn(s)
quedando en disolución
ácido sulfúrico, que producirá un pH ácido aunque no tan ácido como cabría
esperar, ya que también se descarga el H+, como se verá.
Las fotografías que describen este proceso, son las figuras
2, 3, 4, 5 y 6.

Fig.1

Fig.4

Fig.2

Fig.7

Fig.3

Fig.6
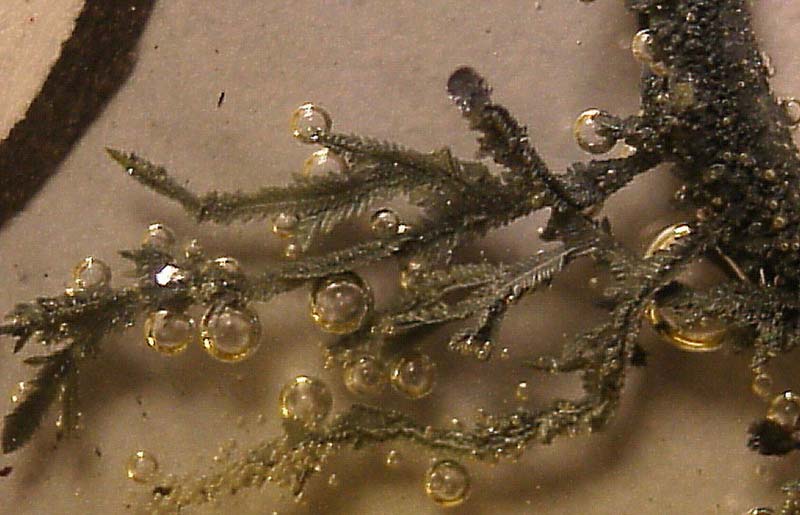
Fig.5
Las fotografías de las figuras 2 a 7 se han tomado en un intervalo de tiempo de 20
minutos.
El desprendimiento de hidrógeno en el cátodo, correspondería
al proceso indicado en la fig.8, proceso dominante inicialmente (fig.2), pero
que posteriormente da paso a la formación rápida del depósito metálico de
cinc.
2N.jpg)
Fig.9
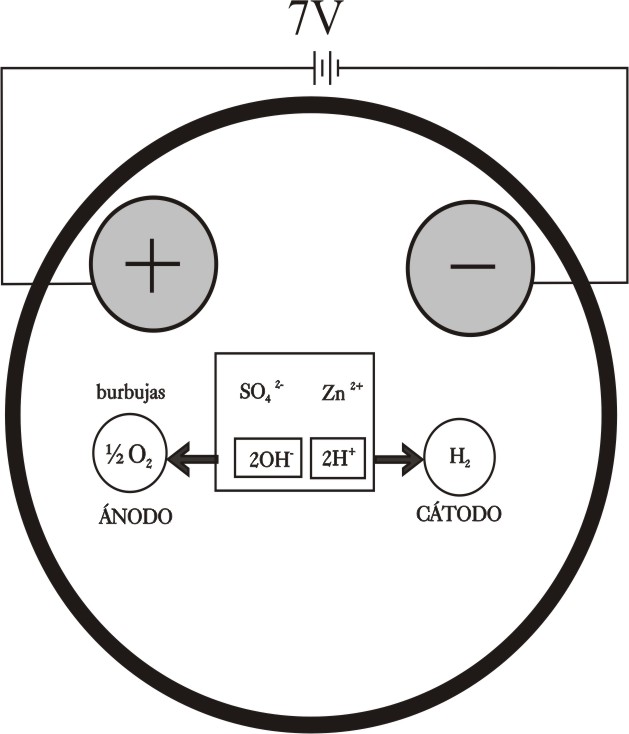
ELECTRÓLISIS DEL NITRATO DE CADMIO(II)
El nitrato de cadmio, muy soluble como el caso anterior,
también produce un depósito metálico de Cd al ser sometido a electrólisis,
de aspecto completamente distinto al del Zn.
Los procesos esquematizados en la figura 9, serían:
En el ánodo se descargará el OH-, y en el
cátodo el Cd2+.
Ánodo : 2OH- -2e = ½ O2 (g) + H2O
Cátodo: Cd2+ + 2e = Cd(s)
quedando en disolución
ácido nítrico que producirá un pH ácido. Las fotografías que describen este
proceso son las figuras 10, 11 y12 sucesivamente.

Fig.10

Fig.11

Fig.12

Fig.13
Si se comparan los árboles producidos en
la electrodeposición metálica del Zn y del Cd, se observa que mientras en
el primer caso el crecimiento arborescente es longitudinal, en el segundo
es más compacto sin que se aprecie tan bien la posible disposición fractal
(véase el detalle de la figura 13).
Prácticamente casi no se ve desprendimiento de hidrógeno en el cátodo (sólo pequeñas burbujas aisladas).
ELECTRÓLISIS
DEL CLORURO DE MERCURIO (II)
En la figura 14, se presenta un esquema
de lo que sucede en las proximidades de los electrodos, de acuerdo con lo
explicado en desarrollos anteriores.
Ánodo :
2Cl- -2e- = Cl2 (g)
Cátodo: Hg2+ + 2e = Hg(l)
.
La disolución debería tener un pH neutro.
Las fotos digitales sucesivas, se dan en las figuras 15, 16,17 y 18.
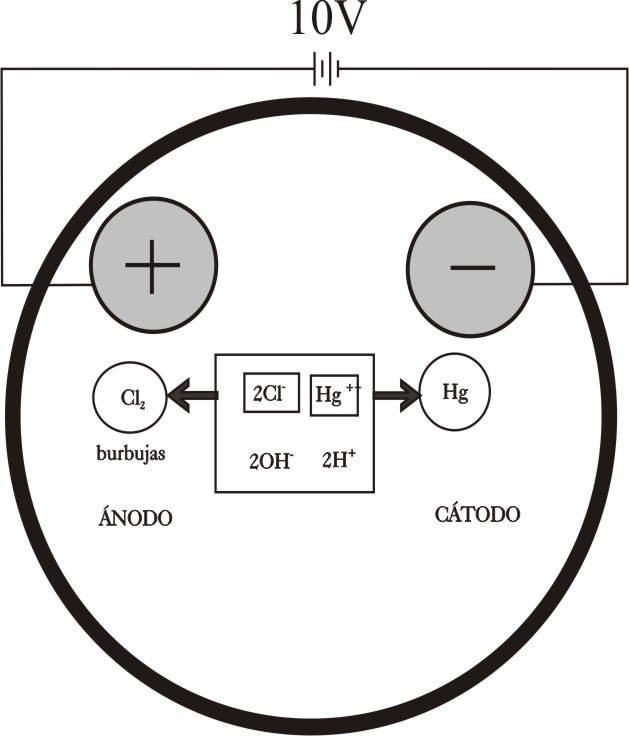
Fig.14
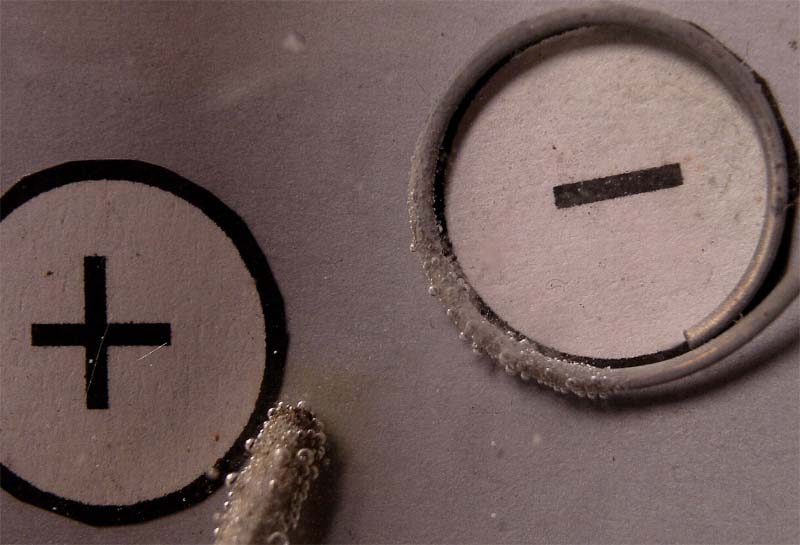
Fig.15

Fig.16

Fig.18

Fig.17
No se observa el crecimiento del depósito
metálico, ya que el mercurio es líquido, pero tampoco se aprecia inicialmente
la formación de sus gotas tan características. Se observa un escaso desprendimiento de burbujas de cloro como
se preveía según el modelo propuesto en la figura 14. Esto se justificaría
por reacción del cloro con el metal del electrodo.
Sin embargo lo que se observa en el cátodo es el desprendimiento dominante de hidrógeno, según el esquema de la fig. 19. Posteriormente también se nota la formación de gotas de mercurio, encubiertas por el desprendimiento de hidrógeno (véase la parte superior del cátodo circular de la fig. 18). Este hecho se podrá apreciar mejor en el detalle que se presenta en la figura 20, así como en la fotografía del cátodo después de la electrólisis, en la que se muestra la formación de gotas y amalgamas de mercurio (fig.21).
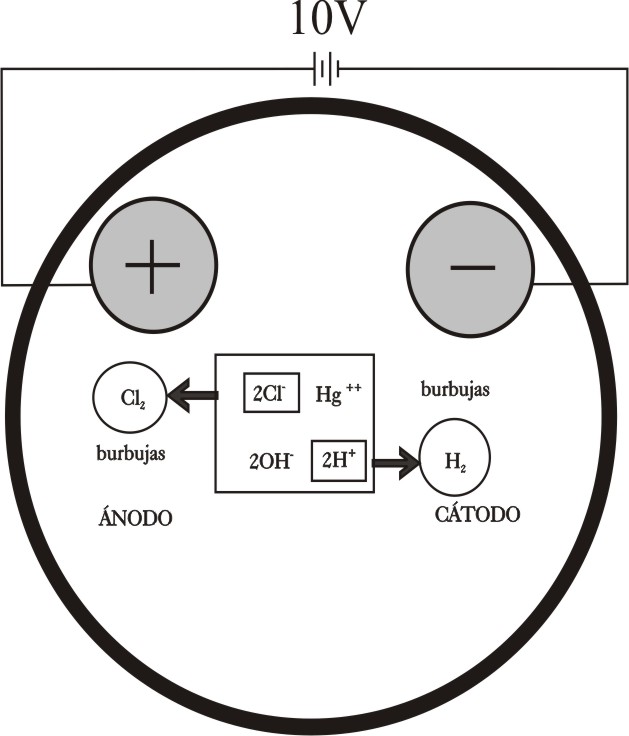
Fig.19
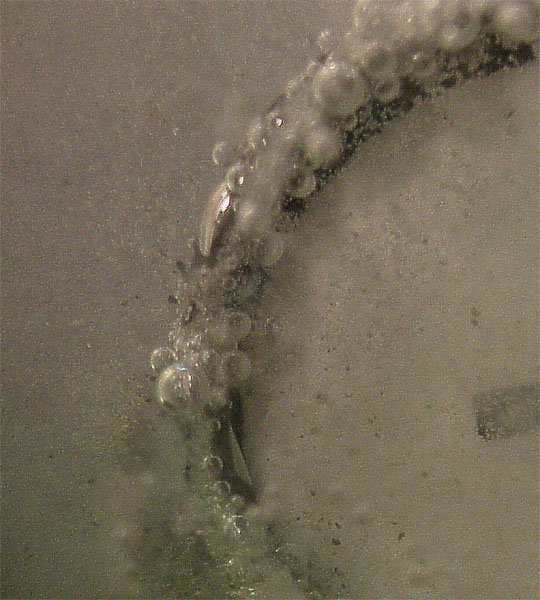
Fig.21
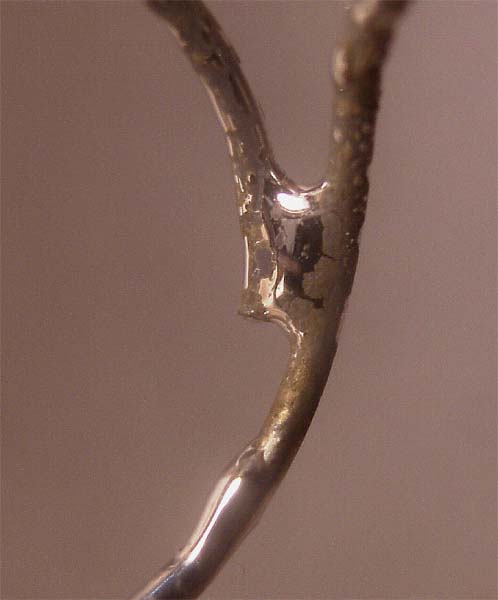
Fig.22