
Fig.1
GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
LA ELECTRÓLISIS DE DISOLUCIONES SALINAS
(II)
Se van a presentar tres electrólisis en diferentes condciones
y con distintos electrodos, a fin de observar la influencia de estas condiciones
en sus resultados a través de la fotografía digital. Las sales sometidas a
electrólisis son: sulfato de cobre(II), cloruro de
cobre(II) y cloruro de cobre(I).

Fig.1
ELECTRÓLISIS DEL SULFATO DE COBRE(II)
La electrólisis del sulfato de cobre (II), sal bastante
soluble en agua, se produce a través de los fenómenos descritos en el dibujo,
de acuerdo con la facilidad de descarga
de los iones en los electrodos respectivos dada en la figura 2 de primera parte de este trabajo. Se emplean primeramente
electrodos metálicos.
En el ánodo se descargará el OH-,
y en el cátodo el Cu2+
Ánodo : OH- -2e = ½ O2 (gas) + H+
Cátodo: Cu2+ + 2e = Cu(s)
quedando en disolución
ácido sulfúrico, que producirá un pH ácido que se puede caracterizar con el
indicador apropiado.
La sucesión de fotografías que describen este proceso
son las figuras 3, 4 y 5
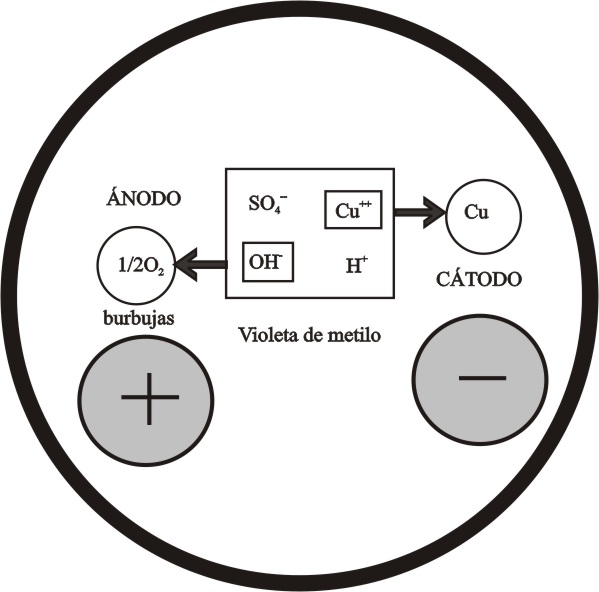
Fig.2

Fig.3

Fig.4

Fig.5
En la figura 5, se agregó a la cubeta violeta de metilo,
que en la zona del ánodo va a presentar un color azul, o sea pH ácido (aunque
no en exceso).
Se observa perfectamente el desprendimiento de oxígeno en forma de burbujas, en el ánodo, mientras que se deposita cobre metálico en el cátodo.

Fig.7

Fig.6

Fig.10
ELECTRÓLISIS
DEL CLORURO DE COBRE (II)
La electrólisis de cloruro de cobre (II), se realiza
primero con electrodos metálicos, partiendo de una disolución 0,1M.
En la figura 8, se presenta un esquema de
lo que sucede en las proximidades de los electrodos, de acuerdo con lo explicado
en desarrollos anteriores.
Ánodo : 2Cl- -2e- = Cl2 (gas)
Cátodo: Cu2+ + 2e = Cu(s)
La disolución tendrá un pH neutro.
Las fotos digitales sucesivas, se dan en
las figuras 9, 10,11 y 11. En estas dos últimas se ha agregado violeta de
metilo.
Se observa el crecimiento del depósito metálico,
en forma de árbol, así como el escaso desprendimiento de burbujas de cloro
como se preveía según el modelo propuesto en la figura 8. Esto puede justificarse por reacción del cloro con el metal
del electrodo.
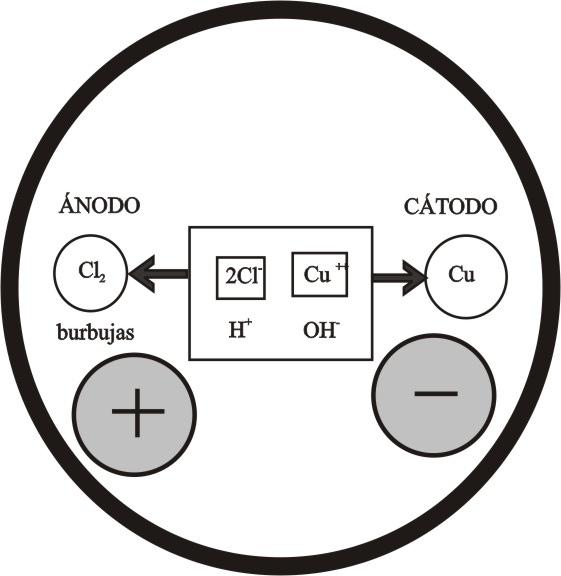
Fig.8

Fig.9
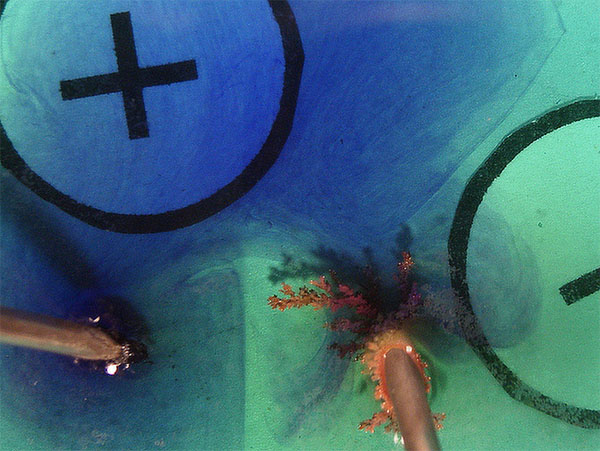
Fig.11
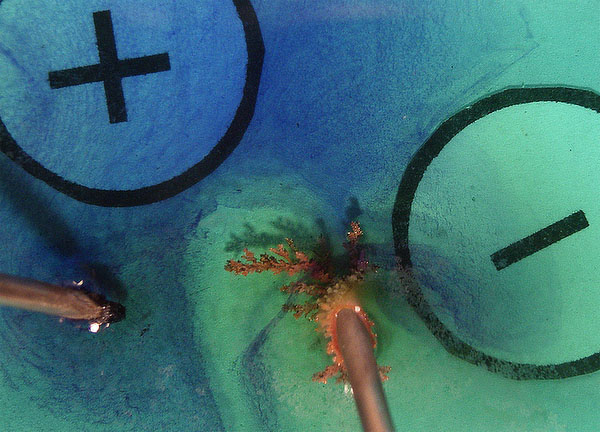
Fig.12

Fig.14
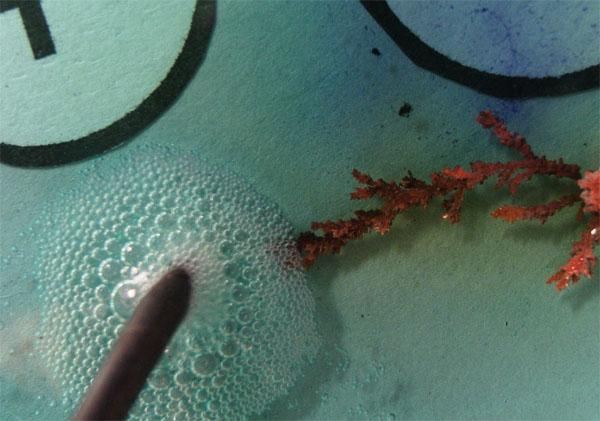
Fig.15

Fig.13

Fig.16
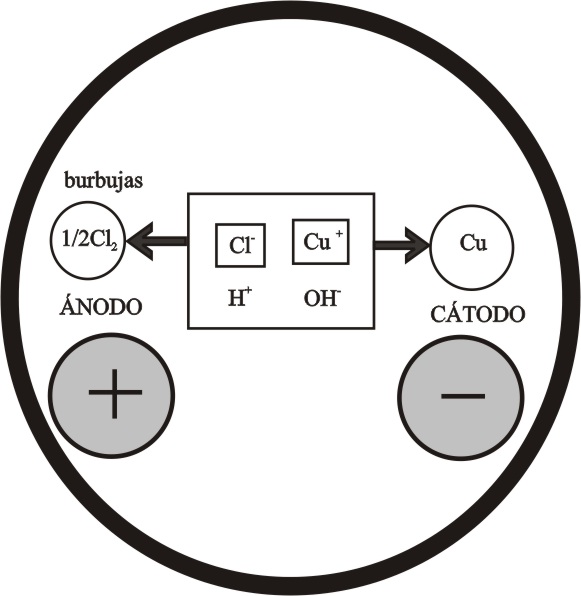
Fig.17
ELECTRÓLISIS DEL CLORURO DE COBRE(I)
El cloruro de cobre(I), difiere
totalmente del cloruro de cobre(II), no solamente en el color (gris verdoso)
sino especialmente en su solubilidad en el agua, ello hace que la concentración
de iones en disolución sea muy pequeña, lo que modifica
su descarga en los electrodos.
Cabría suponer las reacciones indicadas en el esquema de la figura 17, según el criterio de descarga, sin embargo lo que realmente ocurre es lo que se especifica en la figura 18.
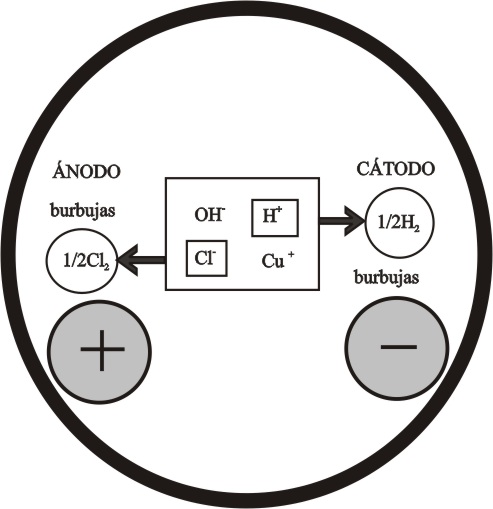
Fig.18

Fig.20

Fig.19
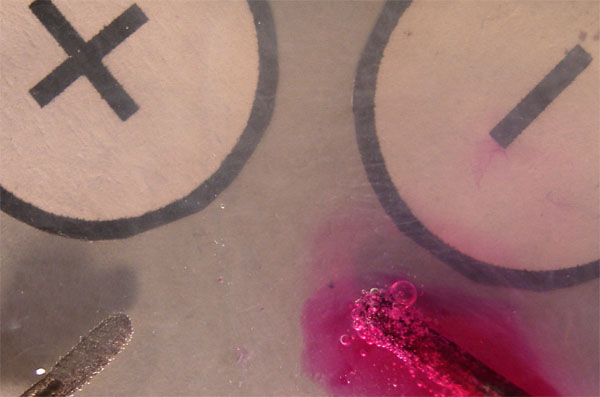
Fig.21
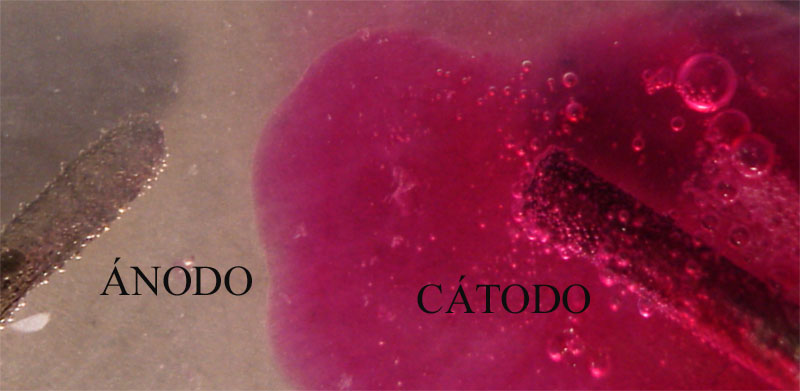
Fig.22

Fig.23

Fig.24

Fig.27
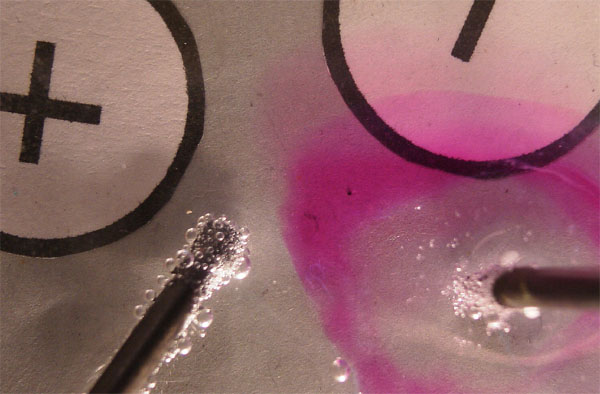
Fig.26
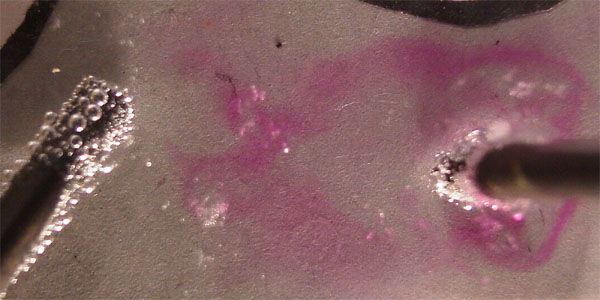
Fig.25