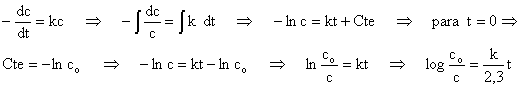GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Cinética de la reacción entre los iones peroxodisulfato y yoduro (Solucionario)
1) El fundamento de la práctica
es el siguiente:
Para la velocidad de reacción, admitimos como
hipótesis que es proporcional a la concentración de peroxodisulfato, matemáticamente
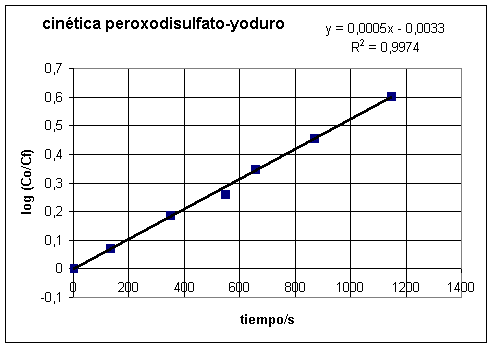
La última ecuación nos dice que
al representar el logaritmo decimal del cociente de las concentraciones
frente al tiempo es una línea recta. Si eso ocurre experimentalmente es
que la hipótesis de partida es correcta
2) Los cálculos son los siguientes
Co = Concentración inicial de peroxodisulfato
Justamente en el momento de iniciarse la reacción
tenemos un volumen total de 30 mL ( no contamos las gotas de indicador). Hemos diluido tres veces la disolución de peroxodisulfato
Co
= Concentración inicial de peroxodisulfato =
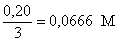
.
Vamos a hacer los cálculos para cuando añadimos
10 mL de tiosulfato
De acuerdo con las ecuaciones químicas 1 mol de peroxodisulfato equivale a 2 moles de tiosulfato .
Los moles de tiosulfato que hemos puesto son
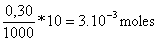
Los moles de peroxodisulfato que han reaccionado
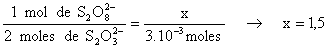 .10-3 moles
.10-3 moles
Los moles de peroxodisulfato que quedan sin
reaccionar son los iniciales menos los que se han gastado
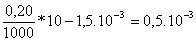 moles que están contenidos en 30
ml de disolución
moles que están contenidos en 30
ml de disolución
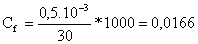
El cálculo para cuando se añaden 8,7 moles de tiosulfato es el mismo y que resumimos sin más explicaciones
*Los moles de tiosulfato que hemos puesto son
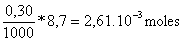
* Los moles de peroxodisulfato que han reaccionado
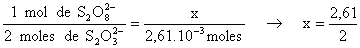 .10-3 moles
.10-3 moles
*La concentración Cf
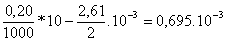 moles contenidos en 30 mL de disolución
moles contenidos en 30 mL de disolución
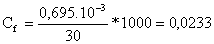
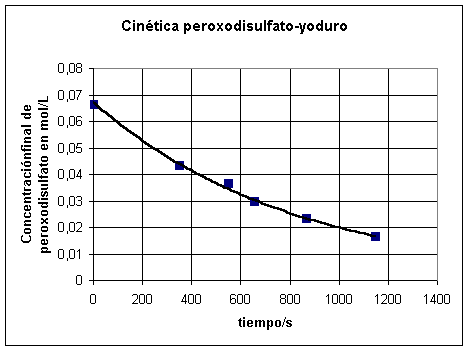
Recogemos todos los datos en una tabla junto
con los tiempos obtenidos en un experimento
| Cf en mol/L |
Coen mol/L |
Co/Cf |
log (Co/Cf) |
tiempo/s |
| 0,0666 |
0,0666 |
1 |
0 |
0 |
| 0,0166 |
0,0666 |
4,01204819 |
0,60336614 |
1146 |
| 0,0233 |
0,0666 |
2,8583691 |
0,45611831 |
868 |
| 0,03 |
0,0666 |
2,22 |
0,34635297 |
657 |
| 0,0366 |
0,0666 |
1,81967213 |
0,25999314 |
548 |
| 0,0433 |
0,0666 |
1,53810624 |
0,18698633 |
351 |
| 0,0566 |
0,0666 |
1,17667845 |
0,0706578 |
135 |