
Fig.1
GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA

Fig.1
ALMACÉN
La reacción química que se produce es :
K2CrO4+BaCl2 → BaCrO4 (precipitado amarillo) +2KCl

Fig.9
Reacciones de
precipitación 19
Precipitación del Ba(II). Primera parte.
Por lo general, los metales pesados, suelen dar reacciones de precipitación perfectamente visibles. En este caso vamos a escoger una disolución saturada de cloruro de bario, para visualizarlas. Fue muy conocida la papilla de sulfato de bario en usos médicos para realizar una radiografía intestinal, precisamente porque el bario al ser un metal pesado, no era transparente a los rayos X.
19.1. Precipitación
del sulfato de bario
Primeramente sobre una disolución de cloruro bárico, echamos unas gotas de disolución de ácido sulfúrico 6N , formándose un precipitado blanco de sulfato de bario (Kps=1,8.10-10), que toma formas muy curiosas como se puede apreciar (fig.1-7). La sucesión de fotos está hecha con un intervalo de 0,3 segundos.

Fig.3
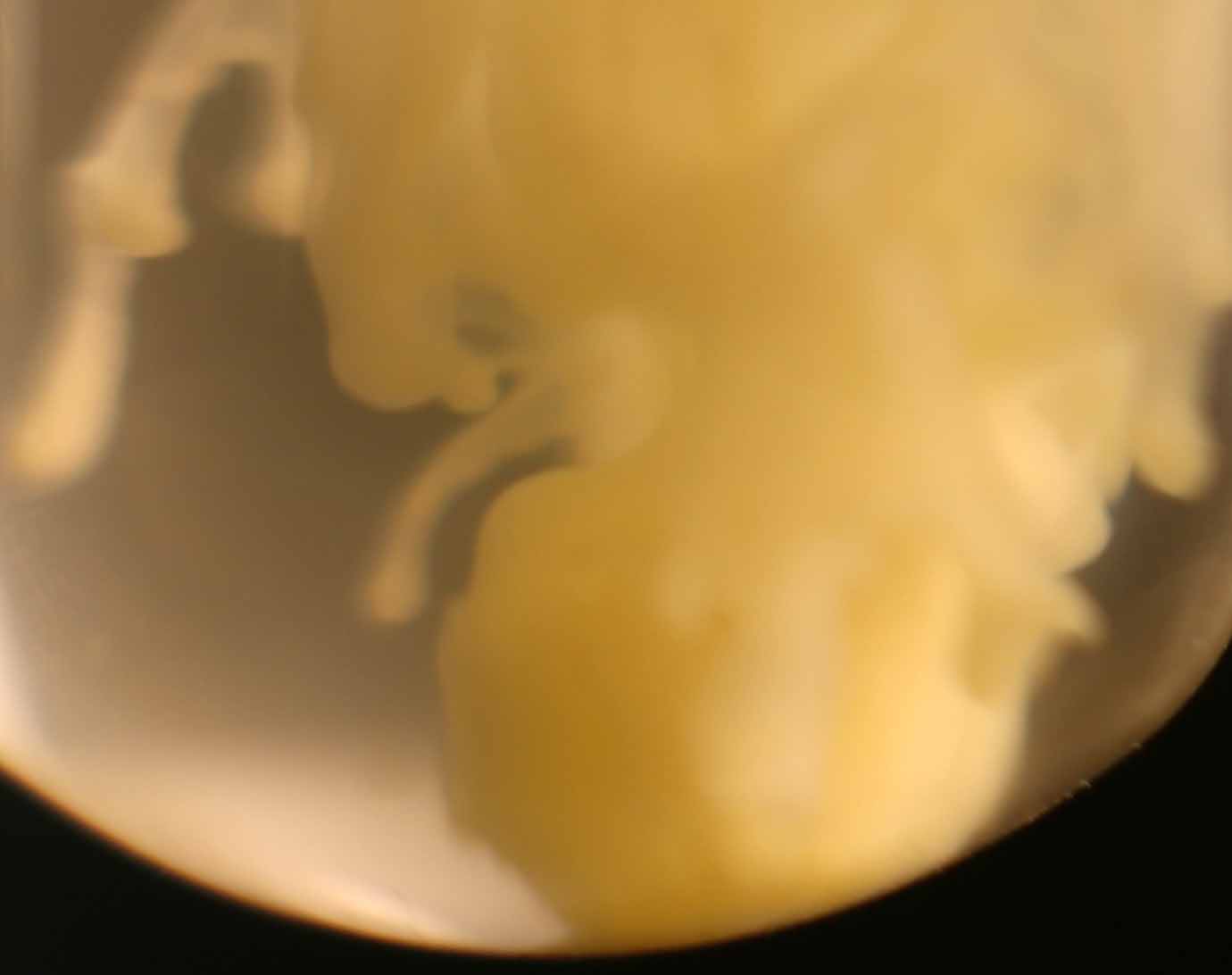
Fig.7(detalle)

Fig.8

Fig.10
La reacción química que se produce es :
H2SO4+BaCl2 → BaSO4 (precipitado blanco) +2HCl
19.2. Precipitación del cromato de bario
Otra precipitación característica del bario es en forma de cromato de bario (Kps=1,17.10-10), primero forma una capa superficial, que se irá poco a poco depositando en el fondo (Fig.8-14). La sucesión de fotos 10-13. está hecha con un intervalo de 0,3 segundos. La última fotografía fue tomada 1 hora después.

Fig.14(ampliación)

Fig.9

Fig.12

Fig.5
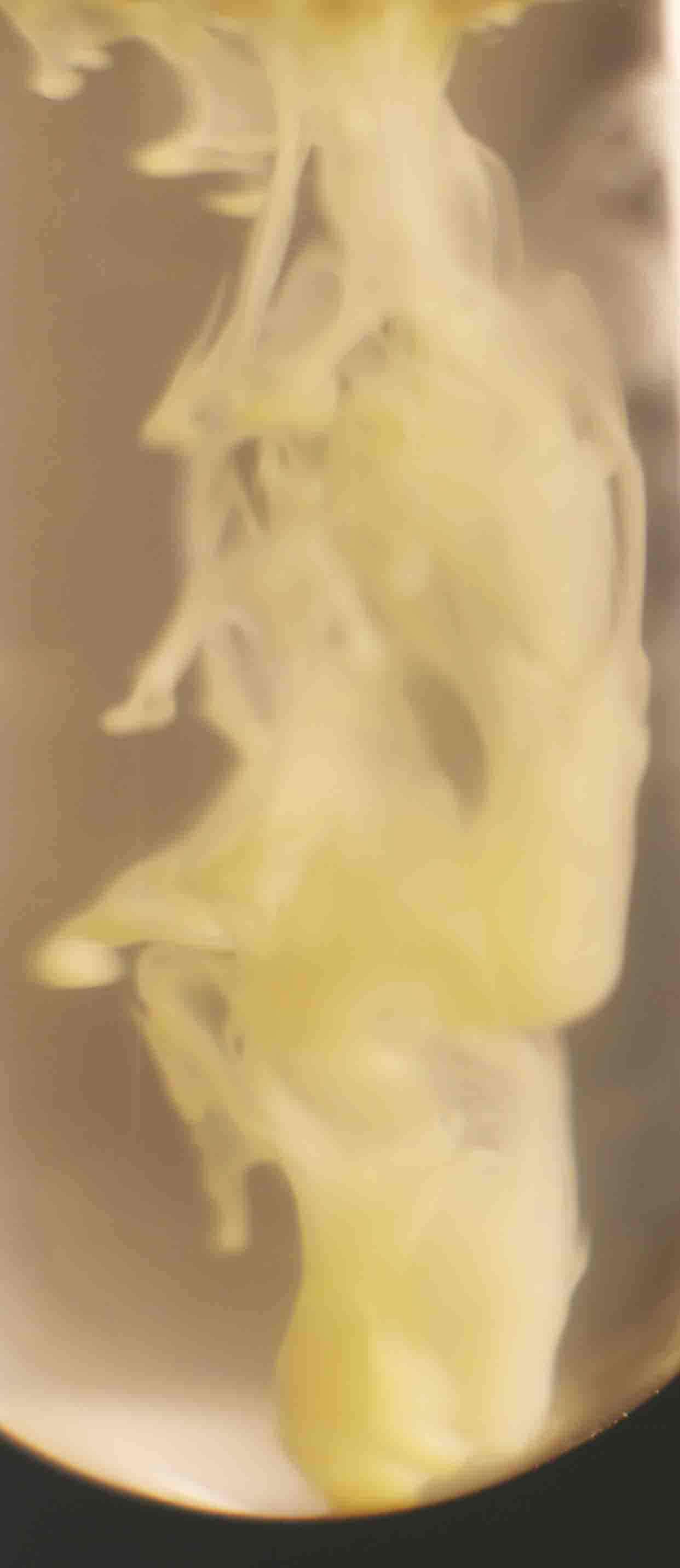
Fig.2

Fig.11
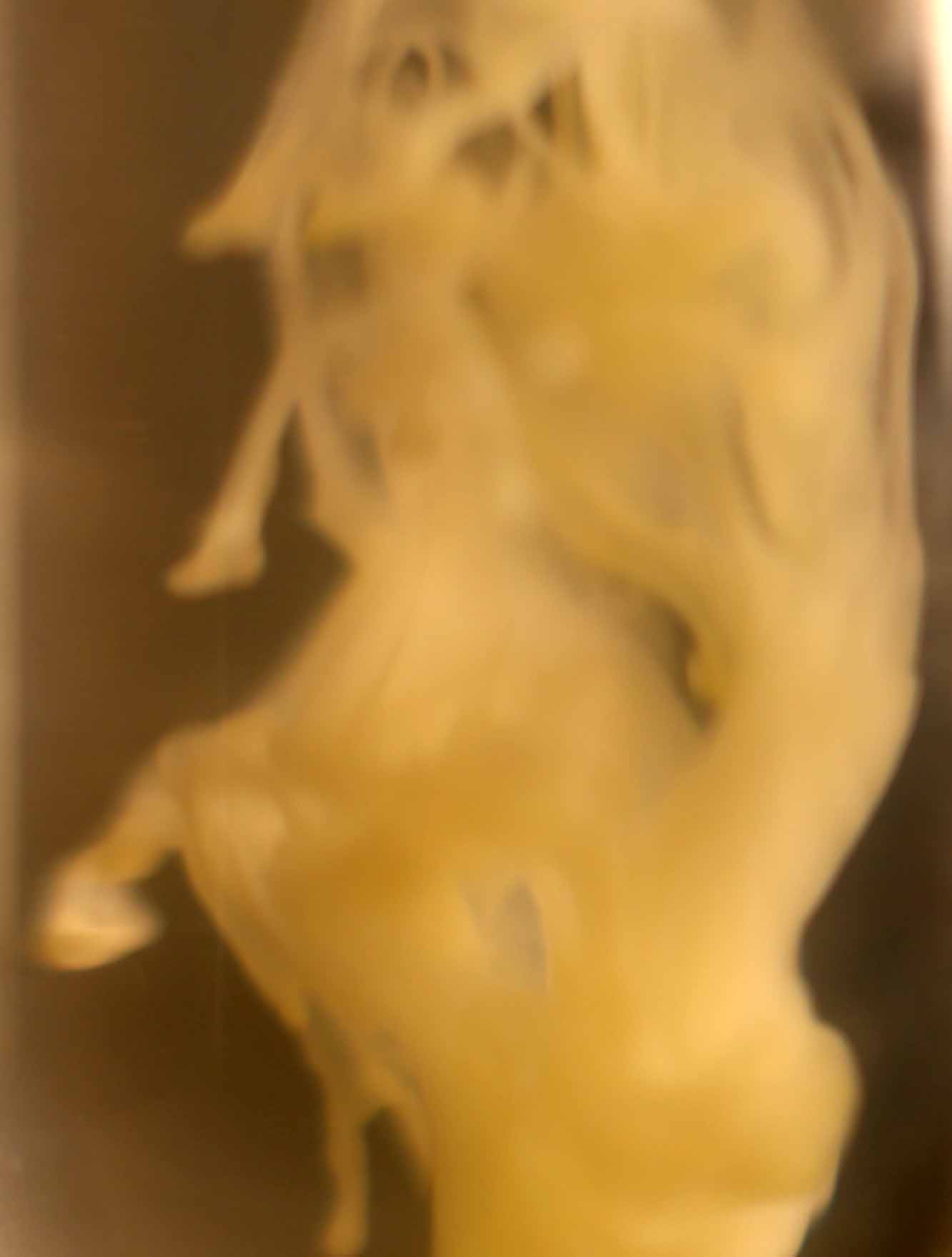
Fig.6

Fig.4