GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Determinación del agua de cristalización del sulfato
de cobre(II) (Solución)
Cálculos
Masa de la cápsula de porcelana M1 = 83,29g
Masa de la cápsula de porcelana con sulfato de cobre(II) en polvo M2
=156,92g
Masa de la cápsula
con el producto deshidratado M3=130,39
Masa de sulfato
de cobre hidratado M2-M1
=73,63g
Masa de agua perdida
M2-M3 = 26,53g
La fórmula del sulfato
de cobre hidratado la escribimos para este experimento así:
![]()
siendo x la incógnita que se debe deducir a partir de los datos experimentales
Masa molar del
![]() , MS = 63,55+32,06+4*16,00+
x*18,02 = 159,61+ x*18,02
, MS = 63,55+32,06+4*16,00+
x*18,02 = 159,61+ x*18,02
Pero
como
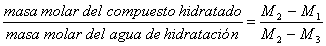
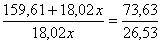 ; x = 4,99
; x = 4,99
Por lo que habrá 5 moles de agua de cristalización por mol de sulfato de cobre (II)