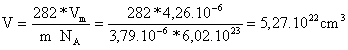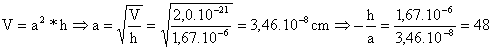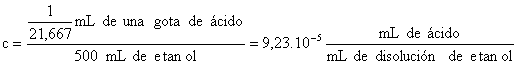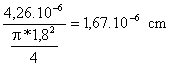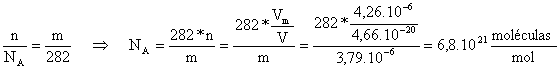GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
DETERMINACIÓN APROXIMADA DEL NÚMERO DE AVOGADRO (SOLUCIÓN)
Cálculos
Los resultados
de un experimento son los siguientes
Datos
-Densidad del ácido oleico, D = 0,89 g/mL
-Masa molar del ácido oleico, M =282 g/mol
-Número promedio de gotas de ácido oleico en un ml de ácido puro
ng =21,667
Se añade una
gota de oleico puro en 500 mL de etanol puro.
-Volumen de una gota de ácido oleico puro VG =
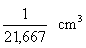
-Concentración de ácido oleico en la disolución de etanol
Se añade una
gota de la disolución de etanol sobre el agua espolvoreada con talco.
Se obtiene una mancha de ácido sobre el agua
-Diámetro promedio de la mancha D = 1,8 cm
-Superficie de la mancha S =
=
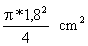
-Mililitros de ácido oleico que hay en la mancha
Vm = VG*c =
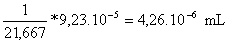
-Masa de ácido oleico que hay en la mancha
m =Vm*D=
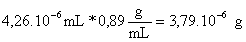
Se admite que
las moléculas de ácido oleico son prismas de base cuadrada de lado a y
altura h y que están juntas. La superficie de la mancha S por la altura
h nos da el volumen de oleico añadido al agua = volumen de la mancha
Se toma como hipótesis de trabajo que la altura de la molécula es diez
veces mayor que el lado a
- El volumen de una molécula es
V = a2*h =
![]() =
=
![]()
-Sea n, el número de moléculas de oleico que existen en la mancha y NA el número de Avogadro.
nV= volumen de la mancha = Vm
Considerando
que el número de Avogadro es 6,02.1023, de la expresión anterior
se deduce el valor de V