
Jacobus Henricus Vant'Hoff de los 21 años, en Bonn
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA

Jacobus Henricus Vant'Hoff de los 21 años, en Bonn
Jacobus Henricus Vant’Hoff [1] , nace en Rotterdam el 30 de agosto 1852. Su padre con su mismo nombre, era médico. Fue el tercero de sus 7 hijos. Su madre fue Alida Kolff. Estudia en Hoogere Burger School, hasta los 17 años, mostrando grandes aptitudes para las ciencias, según sus profesores, graduándose después de dos años con buenas calificaciones en matemáticas, mecánica y ciencias físicas. En contra de los deseos de su padre, estudia ingeniería química en el instituto politéctico de Delf, donde se matricula en septiembre de 1869, graduándose como “technoloog” (ingeniero químico) en 1871. Se matricula en la universidad de Leiden, en 1871, en la cual está solo un año, pues al siguiente va a estudiar a Bonn, con Kekulé [2] , y en 1873 a París con Wurtz, volviendo a Holanda, a la Universidad de Utrech, donde se matricula el 23 de octubre, para doctorarse con E.Mulder. Mulder le aconseja que como tema del doctorado, haga una investigación sobre los ácidos cianoacético y malónico. El 22 de diciembre de 1874, defiende la tesis con el título:”Contribución al conocimiento de los ácidos cianoacético y malónico” [3] .
Sin embargo lo importante no fue su tesis, sino un pequeño panfleto de 22 páginas escrito en holandés, sin nombre inicial del autor [4] , que publica el 5 de septiembre de 1874. Su título traducido dice:”Propuesta para la extensión de la formulación actualmente en uso, en la química del espacio y la relación entre el poder rotatorio óptico y la constitución de los compuestos orgánicos”. En su “Voorstel (propuesta), va a explicar la isomería óptica y la geométrica.
Por sugerencia del profesor Buys Ballot de la universidad de Utrech, en mayo de 1875, se publica en francés con el título “La chimie dans l’Espace”, ahora con 44 páginas, llamando la atención de químico francés Joseph Le Bell, que había tenido una idea similar.

Portada de su primer trabajo
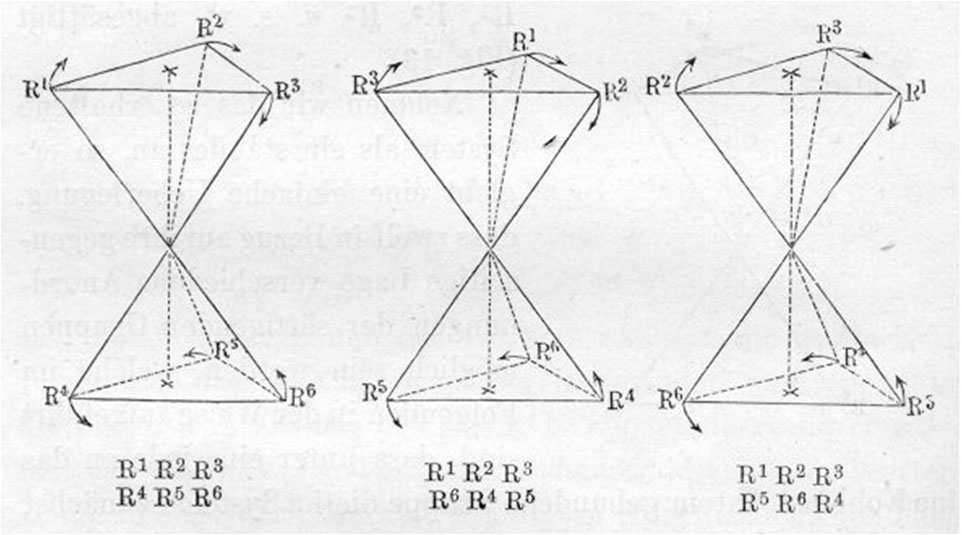
Explicación de los isómeros ópticos en su primer trabajo (Propuesta..."
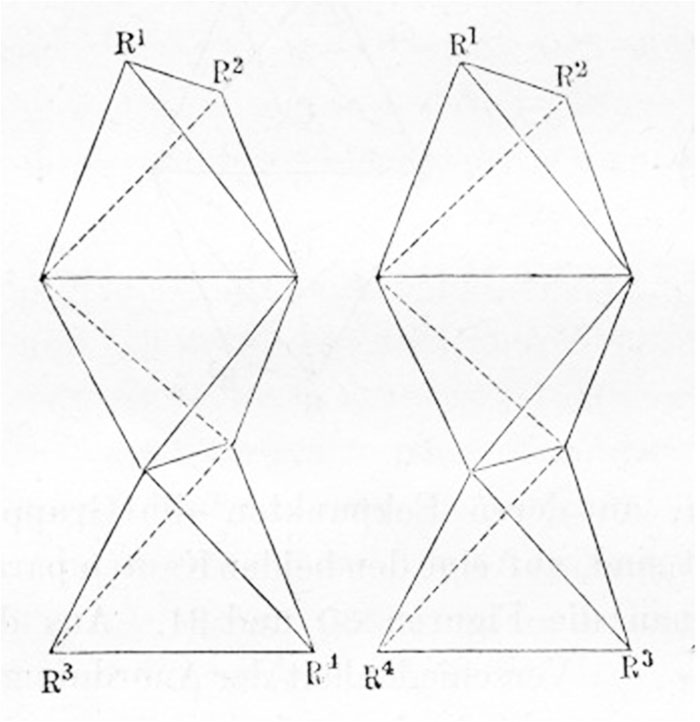
Explicación de los isómeros geeométricos en su "propuesta"

Sus primeros modelos espaciales hechos en julio de 1875, con su amigo Bremer,para su tesis
Vnt'Hoff en la universidad de Amsterdam
Su trabajo en francés [5] , será muy divulgado, y conocido en Alemania y traducido al alemán “Die Lagerung dier Atoms in Raume” en 1877, pero al inglés solo en 1891. Sin embargo aunque fue muy discutido en su época [6] , no era una idea revolucionaria [7] , además como decían sus primeros críticos holandeses, carecía de base experimental [8] .
El primer químico holandés que hizo uso de sus teorías, en su doctorado fue Gustav Jacob Bremer, en su tesis de 15 de octubre de 1875, sobre “El ácido málico dextrorrotatorio” [9] .
En 1876, obtuvo el cargo de profesor ayudante de química en el Colegio Veterinario de Utrecht. Ese mismo año presenta una investigación sobre el estireno [10] , a partir de un experimento que había realizado Bertellot.
Al año siguiente consigue una plaza como ayudante de Química en la universidad de Amsterdam, donde permanecerá 18 años. También en 1877 comienza a escribir un voluminoso libro de 554 páginas [11] , que terminará editándose en 1884, con el título “Estudios de dinámica química”, en el que establece de forma independiente de los suecos Guldberg y Wage, la ley de acción de masas.
En 1878, se casó con Johanna Francina Mees, con la que tendrá 2 hijas; Johanna Francina y Aleida Jacoba, y dos hijos: Jacobus Enricus y Govert Jacob, este último nacido en 1889.
En 1885, presenta uno de sus trabajos más importantes: ”Laws of Equilibrium in Dilute Gaseous or Dissolved Systems” en el que expone que las leyes de los gases se podían aplicar a las disoluciones diluidas, como si las partículas disueltas se movieran libremente a través del disolvente, presentando su ya famosa fórmula de la presión osmótica, en la que introduciría el factor i, para los electrolitos de Arrhenius.
En septiembre de 1887 obtiene, por fin, un puesto como asistente de Química en su universidad, con un sueldo anual de 1000 florines [12] .
A través de sus trabajos sobre disoluciones comienza a colaborar con Ostwald, con el cual fundará una publicación química especializada: “Zeischrift für physilkalische Chemie” ( Diario de química física).
En 1893, le conceden la medalla Davy.
En 1896, acepta una invitación de la Academia Prusiana de las Ciencias, para dar clases en la Universidad de Berlin, puesto que le abrirá las puertas científicas mundiales.

Vant'Hoff trabajando con Ostwald en su laboratorio

Vant'Hoff en Berlin

Vant'Hoff al final de su vida

[1] Sus amigos le conocerán con Henri
[2] La primera fotografía que se adjunta se la hizo un compañero (Wersthoven), en Bonn, para enviársela a su madre
[3] La tesis que recibió un “summa cum laude”, fue considerada insignificante desde el punto de vista científico, y como “un regalo de navidad”, aunque debe tenerse en cuenta que sólo tenía 22 años.
[4] El nombre solo aparecía al final
[5] En el documento del 75 en francés, dice: “Esta teoría está de acuerdo con los hechos (viendo el número de isómeros predi- chos), si se consideran las afinidades del carbono dirigidas hacia los vértices de un tetraedro, en el que el carbono está en su centro… cuando las cuatro afinidades del carbono están satisfechas por cuatro grupos univalentes diferentes, se producen dos o mas tetraedros diferentes, uno de los cuales es imagen del otro, no siendo superponibles”. El problema de van’t Hoff, fue que era “demasiado joven” (tenía 22 años), para la importancia de lo que postulaba. Este hecho le impidió a ser admitido en la Academia de Ciencias, el 27 de marzo de 1880, ya que sacó 14 de 27 votos, necesitándose los 2/3 del total. Tuvieron que pasar 5 años para ser admitido, el 28 de mayo de 1885, obteniendo 28 votos de 31.
[6] Kolbe, reconocido químico alemán y editor de la revista “Journal für practische Chemie”, escribía en un artículo en mayo de 1877, sobre el epígrafe “El signo de los tiempos”: “Un tal Dr. J. H. van’t Hoff, que tiene un puesto en la escuela veterinaria de Utrecht, aparentemente no guarda gran aprecio por la precisión en las investigaciones químicas. Le ha parecido más conveniente montarse en el caballo Pegaso (alquilado por supuesto en la escuela veterinaria) y proclamar en su “La Química en el espacio” cómo, durante su atrevido vuelo a la cima del Parnaso de la Química, los átomos se le aparecieron organizados en el espacio cósmico.” Ese mismo año, Ladenburg, conocido químico e historiador, escribe en el Berichte:” Van’t Hoff introduce en sus fórmulas algo que yo y la mayoría de los químicos no hacemos con buenos motivos, esto es, la representación espacial. Lo que yo entiendo por una fórmula y lo que pretendo que se comprenda por tal, ha sido expresado en distintos lugares, en especial en el artículo de van’t Hoff: Una fórmula debe dar cuenta de la composición, el peso molecular y la forma en que los átomos están unidos unos a otros”.
[7] Sin embargo este trabajo tuvo la virtud, al definir al carbono asimétrico de justificar la isomería óptica, comprobando las teorías de Pasteur. Precisamente este científico francés en 1822 para explicar las propiedades ópticas de los ácidos tartáricos, había supuesto una estructura espacial con base en un tetraedro irregular, para justificar la asimetría a la que atribuía dichas propiedades También justificará la isomería geométrica, término especificado por él, para explicar el comportamiento de los ácidos fumárico y maleico, isómeros debido a la imposibilidad de rotación a través de la arista de unión de los tetraedros. La justificación implicó una representación espacial del doble y del triple enlace, en el eteno y etino, con dos tetraedros unidos por una arista o por una cara.
[8] En Holanda tuvo críticas negativas, como las de Rudoopf Sicco, profesor de la universidad de Groningen, pero también las tuvo positivas como las de Jan Wilem Gunning, profesor de Química de Amsterdam, que el 23 de julio de 1876, le procuró un encuentro con Dom Pedro II, emperador de Brasil, que sentía gran curiosidad por Vant’Hoff.
[9] Su director de Tesis fue el mismo que había tenido Vant’Hoff.
[10] El estireno, como el benceno se extraían del benjuí, una especie de resina del árbol styrox(de ahí su nombre), y el compues-to levógiro destilado de aquél, estudiado por Vant’Hoof, fue llamado por éste styrokamfer.
[11] El prefacio del libro data de octubre de 1877, y estaba dedicado al profesor MacGillavry, director de la escuela veterinaria de Utrech, donde había trabajado antes.
[12] Dicho sueldo tenía que compartirlo, con su ayudante Van Deventer, que se dedicaría en la parte experimental, a preparar las membranas semipermeables para las medidas de la presión osmótica.
[13] En el discurso de concesión del primer premio Nobel, se aseguraba que” Como resultado de sus investigaciones en los campos de la energía atómica y molecular van't Hoff ha hecho los descubrimientos más importantes de la química teórica desde los tiempos de Dalton”.
En Berlin, con pocas obligaciones docentes, estudia los depósitos salinos de Stasfur,
En 1901, le
conceden el primer Nobel de Química, por su teoría de las disoluciones: “En reconocimiento de los extraordinarios servicios que ha
prestado por el descubrimiento de las leyes de la dinámica química y la presión
osmótica en soluciones"
[13]
.
A lo largo de su vida, sus alumnos y colegas, lo consideraron un hombre bondadoso, de carácter simple y afable.
Fallece en Steglitz, cerca de Berlin, el 1
de marzo de 1911, cuando todavía no había cumplido los 59 años, debido a una
tuberculosis, siendo enterrado en el cementerio de Dahlem,
en Berlin.