 Richards en sus comienzos en Harvard
Richards en sus comienzos en Harvard
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Theodore Richards,
el primer Nóbel de Química, norteamericano.
Actualmente nos parece muy normal
que los Nobel tecnológicos, ya sean
de Física o de Química pertenezcan o se hayan formado en universidades norteamericanas.
Sin embargo los primeros 30 Nóbeles de esas dos disciplinas, fueron europeos.
El primer norteamericano fue precisamente el personaje casi desconocido actualmente,
Theodore Richards, al que le concedieron el Nobel de Química en 1914 “en
reconocimiento a la determinación exacta de los pesos atómicos de un gran
número de elementos químicos”
[1]
.
Nace en un barrio de Filadelfia,Germantown, el 31 de enero de 1868. Sus padres eran artistas, William, pintor y Anna, poetisa. A los 10 años, viaja por Europa con sus padres. Hasta los 14 años fue educado exclusivamente por su madre. Durante un verano conoce en Newport (Rhode Island), a Josiah Parson Cooke, profesor de Química de Harvard y amigo de la familia, que le enseña con un telescopio los anillos de Saturno. Aquí nace su vocación científica., que estará vinculada durante muchos años a su mentor Josiah Parson Cooke. En las navidades de 1880, recibe un regalo con materiales e instrumental para hacer cerca de 200 experimentos [2] . A los 15 años entró a formarse en Ciencias en el Haverford College, donde recibe la influencia del profesor John Marshall, graduándose dos años después, con un trabajo sobre los pesos atómicos del oxígeno y del hidrógeno en colaboración con Cooke [3] . Se matricula en la Universidad de Harvard, licenciándose en Química en 1888. De aquella época son sus primeras publicaciones sobre determinación de pesos atómicos, en el Journal of American Chemical; tenía 20 años [4] .
 Richards en sus comienzos en Harvard
Richards en sus comienzos en Harvard
Consigue una beca y estudia en
Alemania en Gottinga, Munich y Dresde, con Victor Meyer, especializándose
en métodos especiales de análisis químicos
[5]
, volviendo a Harvard donde le nombran profesor asistente
en 1891, adjunto en el 94. En el 95, fallece Cooke, y Richards ocupa su puesto.
Finalmente es nombrado profesor en 1901
[6]
. Dos años después era Jefe del Departamento de Química
de la Universidad de Harvard. Pese a su precaria salud, no faltó nunca a sus
clases, porque no conseguía “desprenderse de sus alumnos”.
En 1896, se casa con Miriam Stuart Thayer, hija del conocido profesor Joseph Thayer, especialista en estudios bíblicos. De dicha unión nacerán una hija, Grace, y dos hijos. Grenough y Teodore William que llegarán a ser profesores de dibujo del politécnico de Virginia y de Química de la universidad de Princeton [7] , respectivamente.
En aquella época los pesos atómicos que inicialmente había calculado Berzelius,
habrían sufrido una revisión por el químico belga Jean Servais Stas, y estos
eran los utilizados por todos los científicos del mundo. Sin embargo ya en
1894, Richards descubre que el peso atómico que él había calculado por el
estroncio
[8]
, era superior en 0,033, del de Stas, sospechando que el
origen del error, no estaba en el elemento sino en el
del cloro, del cloruro de estroncio tomado como muestra. Después analizará
las posibles causas de los errores cometidos por Stas, que al parecer tomaba
muestras demasiado grandes, que podía ocluir no sólo gases
[9]
, sino que eran mucho mas difíciles de purificar. Por ese
motivo Richards y colaboradores, van a tomar muestras pequeñas. Los elementos investigados bajo la dirección inmediata
de Richards o con sus propias manos son los siguientes: oxígeno, cobre, bario,
estroncio, zinc, magnesio, níquel, cobalto, hierro, uranio, calcio, cesio,
cloro, bromo, sodio plata, potasio, nitrógeno, azufre y litio
[10]
. Por todo ello, se le concede la medalla Davy en 1910,
y al año siguiente, la medalla de Faraday de la Sociedad Química inglesa,
para recibir la cual viaja a Londres, en mayo de 1911, con su mujer a Londres
con su esposa y sus tres hijos. Todavía le concederán la medalla Gibbs, en
1912. Estos premios serán el preludio para la concesión del Nobel en
1914.

Richards a los 46 años
A partir de 1903, crea en Harvard, un grupo de investigadores, dedicados a la medida del calor, recordando sus primeros trabajos. Para ello había que modificar los calorímetros que había creado Berthelot. Para efectuar las medidas con la máxima precisión, toma como referencia el calorímetro adiabático, creado por el físico francés Charles Person en 1849, modificándolo y mejorándolo desde 1905 hasta 1925.
 Richards
en 1915
Richards
en 1915
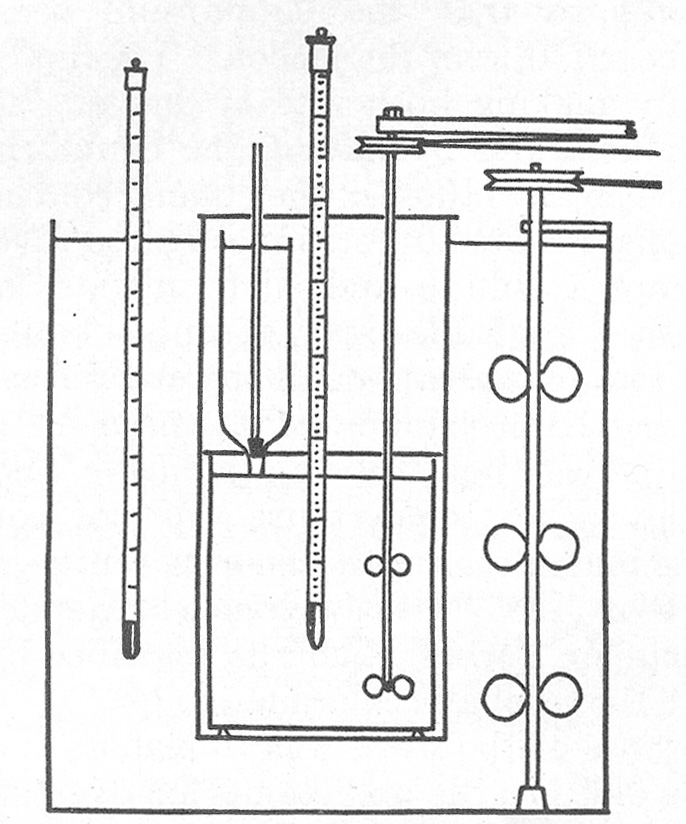
Calorímetro adiabático de Richards, Henderson y Forbes en 1905
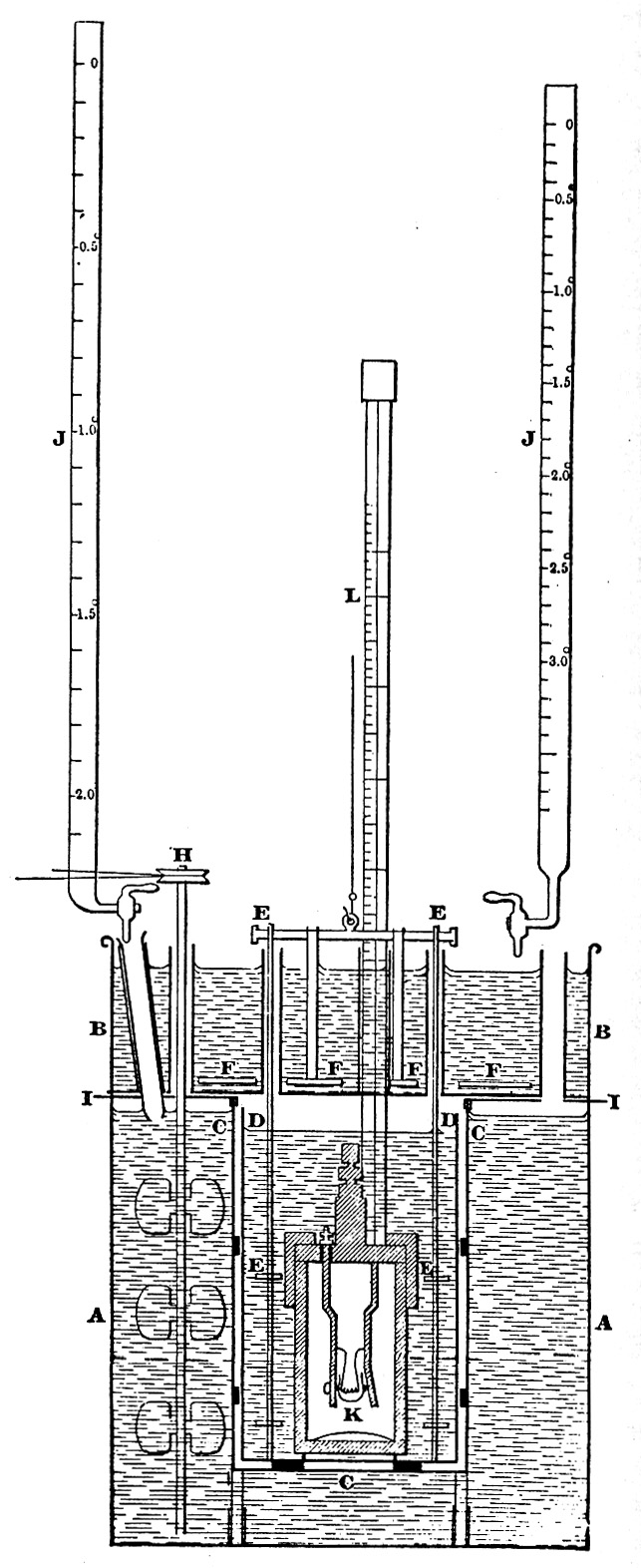
Calorímetro adiabático de Richards y Henderson en 1907
La escuela de Harvard, con Richards y algunos colaboradores a partir de estos momentos se van a dedicar a determinar, calores de combustión de los compuestos orgánicos, calores de disolución de metales en ácidos, calores de neutralización entre ácidos y bases, y calores específicos de diversas sustancias. Su afán fue corregir los datos obtenidos por científicos precedentes, hallados con métodos menos precisos. Desde 1905 hasta su muerte en 1928, publicó junto con sus colaboradores, cerca de 40 trabajos sobre estas medidas [12] . Algunos de los cuales provocaron notables discrepancias con Nernst.
Durante los últimos 13 años de su vida, se dedicará a los estudios
sobre compresibilidad atómica. Sus puntos de vista sobre la naturaleza del
estado líquido y sólido le llevaron a hacer muchas medidas de compresibilidad
de elementos químicos, empleando métodos ideados por él mismo determinó la
compre-sibilidad relativa de 35 elementos líquidos y sólidos, exponiendo la
periodicidad de dicha propiedad, relacionándola con los volúmenes atómicos.
Aparte de ello calculó las compresibilidades de numerosos compuestos tanto
inorgánicos (haluros de litio, sodio, potasio y talio), como orgánicos (hidrocarburos,
alcoholes, ésteres, aminas y halogenuros orgánicos). Estas medidas, le llevaron a relacionar estas propie-dades, con otras,
como tensión superficial etc. La compresión molecular le lleva a estudiar
los parámetros de la ecuación de Van der Waals, incluso elaborando una teoría
sobre la tetravalencia del carbono.
Sus problemas respiratorios, fueron agravándose, falleciendo el 2 de abril de 1928. Sin embargo estuvo trabajando hasta antes de su muerte.
Dos meses antes, como si fuera su testamento, decía:
“Quizá, los trabajos que me produjeron mayor placer intelectual fueron los realizados sobre compresibilidad atómica. Un placer excitante, pero quizá no tan grande como el trabajo experimental minucioso”.
En la universidad de Harvard se conserva un cuadro pintado en 1930, que recuerda a todos sus estudiantes, el que fue su gran profesor de Química y primer Nóbel norteamericano.
Richards a los 60 años
.jpg)
Cuadro de Richards pintado en 1930
[1] El Nobel de Química de 1914, se le concede al año siguiente, debido a los conflictos bélicos (I guerra mundial). El premio lo recibió mucho mas tarde, porque su hijo mayor que iba a acompañarlo a Estocolmo enfermó repentinamente.
[2] Confesará más tarde que estuvo a punto de volar su casa, necesitando 14 semanas de dedicación a la Química, para tener conciencia del peligro al que arriesgaba. Sin embargo su vocación a la química corría parejo con su entusiasmo por la astronomía. Confesaría mas tarde:” A excepción de mi vista un poco defectuosa podría haber elegido convertirme en astrónomo”.
[3] Este trabajo sería publicado dos años después en el J.Am.Chem con el título “The relative values of the atomic weights of hydrogen and oxygen”.Para el hidrógeno solo da una diferencia de 0,0004 , respecto al valor de 1,0078, actualmente aceptado. Sin embargo su primera publicación no sería ésta sino una sobre el calor de reacción producido, cuando el nitrato de plata reacciona con una disolución de cloruros metálicos, en el Chem.New.
[4] A lo largo de sus 40 años de vida científica, presentará 204 publicaciones.
[5] Volverá a Alemania en 1895, pasando un semestre en Leipzig, con Ostwald, y otro en Gottinga con Nernst. Después en 1907, año y medio en Berlín.
[6] Este mismo año fue propuesto para una cátedra de Química en la prestigiosa universidad de Gottinga, prefiriendo quedarse en Harvard como profesor toda su vida. Con ayuda de sus padres, construye una casa, muy cerca de su Departamento en Harvard.
[7] Con éste último publicará en 1924, un trabajo sobre el efecto de un campo magnético sobre el potencial del hidrógeno ocluido en hierro. Los dos hijos terminarán sus vidas suicidándose. Al parecer habían heredado la naturaleza depresiva de su padre.
[8] Para mejorar las medidas sobre el estroncio, crea el nefelómetro, basado en la medida óptica de la turbidez de las disoluciones.
[9]
El comportamiento de óxido de cobre
llevó a sospechar a Richards que el peso atómico del cobre aceptado en
ese momento estaba en un error, y en consecuencia inició una investigación sobre este elemento
que duró cuatro años. Descubrió que los óxidos de metales preparados a
partir de los nitratos siempre contienen gases ocluidos, una circunstancia
que viciaba los trabajos anteriores, no sólo en el peso atómico del cobre,
pero también los de un número grande de otros elementos.
[10] En este elemento se encontró un error superior al 1%, en los valores de Stas.
[11] La teoría de los isótopos había sido establecida por Soddy en 1913.
[12] Incluso después de su fallecimiento, sus colaboradores publicaron en su nombre 6 trabajos sobre medidas de calores específicos y calores de dilución. El último trabajo publicado junto con Malcolm Dole en el J.Am.Chem.Soc, de 1929, llevaba por título “The heats of dilution and specific heats of barium and calcium chloride solutions”