
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
John Frederic
Daniell, el científico inglés con más
medallas
[1]
por sus descubrimientos
El estudiante suele conocer a Daniell, a través de la pila electroquímica
de voltaje casi constante, que estudió en los procesos de transferencia de electrones,
sin embargo lo que no sabe es que muchos otros dispositivos que se encuentran
en su laboratorio fueron creados y diseñados por este científico inglés.
Nace el 12 de marzo de 1790, en un pueblecito inglés; Strand. Su padre jurista de prestigio, vinculado a la antigua orden de los Templarios, querría para su hijo una formación de letrado, sin embargo desde muy joven mostró cualidades la especiales para la investigación de la ciencia aplicada, tomando muchos de sus conocimientos a través de los artículos de la enciclopedia británica. Así a los 19 años concibe una máquina para refinar azúcar. En 1812, se subscribe a la Royal Institution, la Academia de Ciencias inglesa, de la cual es nombrado miembro dos años después. Por eso sus primeros trabajos se publicaron en el Quarterly Journal de esta institución. Esta colaboración durará toda su vida. En 1828 en el compendio que hace esta sociedad sobre los conocimientos actuales, Daniell escribe la parte de Química.

Fig.1
 Daniell le enseña el higrómetro
a Faraday
Daniell le enseña el higrómetro
a Faraday
Dentro de los primeros trabajos publicados,
destaca el estudio de la solubilidad en diferentes disolventes de
sales cristalizadas de distintos metales, en 1815. Destaca especialmente
su estudio sobre los alumbres amorfos, que podían cristalizar en agua, una
parte formando iones piramidales y otra, tetraédricos.
Tres años después publica la primera explicación sobre la densidad
de cristales, suponiendo los átomos esféricos.
No todas sus investigaciones fueron
éxitos. El año 1819, fue el de su mayor fracaso. Desde 1818 trabajaba sobre
las sustancias obtenidas al calentar lentamente, alcanfor y trementina en
éter, con un catalizador de platino. Reconoce un compuesto desconocido con
propiedades ácidas que denomina “ácido lámpico”. Publica su análisis en 1819,
y obtiene los “lampatos” de sodio, potasio y bario entre otros. Dieciséis
años después se demostraría la no existencia de un ácido lámpico, y que lo
descubierto no era sino una mezcla de etanoico y etanal.
El año 1820, fue un año importante.
Daniell se dedica a la meteorología. Primero, precisa la composición atmosférica.
Inventa el higrómetro tal como lo conocemos actualmente. Publica 13 trabajos
en los que relaciona la meteorología con la Física y la Química (antes se
había tomado como una ciencia aislada, con importante repercusión en la agronomía
y horticultura del país). En 1823, escribe los “Ensayos meteoro-lógicos”,
a partir de los cuales se dio sentido físico a dicha ciencia. Todos estos
trabajos, culminan en la concesión de la medalla de plata de la sociedad británica
de horticultura. En 1830, construye en la Royal Institution el primer barómetro
de agua
[2]
, que proporcionó durante muchos años los resultados de
presión atmosférica más fiables y precisos de toda Inglaterra
[3]
.
Daniell puede considerarse el “padre
de la meteorología moderna”.
Ese mismo año, idea un pirómetro para medir altas temperaturas y puntos de fusión. Con él averigua el punto de fusión del hierro, aproximadamente 3400ºF [4] . Estos hechos, por su importancia, le valen la concesión de la medalla Rumford en 1832.
En 1817, patenta su idea juvenil, de
purificación del azúcar, mejorada y este hecho llama la atención de las industrias
del gremio. Al relacionarse con la industria, busca otros procedimientos par
mejorar la obtención de productos industriales patentándolos, como la producción
de gas. Todo ello le produce pingües beneficios, y el nombramiento de superintendente
de la compañía “Imperial Continental Gas Asociation”, con unos honorarios
de 1000 libras anuales. Hasta 1929 permanece en tan lucrativo puesto.
En 1831, comienza la función docente,
a partir de la creación del Colegio del Rey del cual es nombrado profesor,
y empieza sus estudios sobre la electricidad, impulsado por su amigo y colega
en la Royal Institution, Michel Faraday. Sus comienzos no fueron exentos de
polémica, al querer imponer sus criterios
reformistas y sus programas, teniendo en cuenta que inicialmente las dotaciones
presupuestarias eran escasas.
En 1833, junto con Miller,
estudia el espectro de numerosos gases, mediante una lámpara de gas, un recipiente
con agua y un prisma, obteniendo diferentes rayas espectrales. Lo aplica a
los vapores de bromo, yodo y cloro, estableciendo analogías entre los dos
primeros pese a que sus colores eran muy diferentes.
Su mujer fallece en 1834,
dejándole al cuidado de 7 hijos, de los cuales sólo dos eran varones.
Inspirado en los trabajos de su amigo
Faraday, repite los experimentos publicados por éste, en “Experimental research”. Daniell se da cuenta de que para llevarlos
a cabo con seguridad y éxito hacía falta una fuente de corriente constante.
Así nació la pila Daniell, cuya foto y esquema original adjuntamos (fig1-3),
así como el primer dibujo tal como apareció en su
“Introduction to Chemical Philosophy”
[5]
de 1839.

Higrómetro de Daniell

Fig.2

Daniell en la Royal Institution
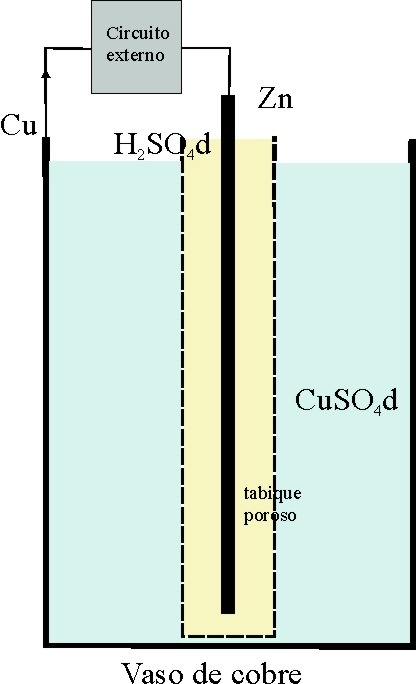
Fig.3

Daniell discute con Faraday un problema

Daniell a los 45 años
Como
se observa el sistema empleado de formulación era el usual en la época, donde
se seguía la teoría de los tipos (véase simbología química, sección Didáctica
de la Física y Química en esta web). El paso dado por Daniell fue muy importante
porque a partir de él se comenzó a considerar el anión sulfato. Este trabajo
hace que le concedan en 1842, la Medalla Real de la Real Sociedad; era su
cuarta medalla al mérito científico. Igualmente recibe el grado de “Doctor
honorario de derecho civil” por la universidad de Oxford.
Dos años después, publica junto
con Miller:”Additional researches on the electrolysis of secundary
compounds”. En este
trabajo se señala que: “Las cantidades
de cationes y aniones
[7]
que se depositan en los electrodos siempre son equivalentes
y el número de cationes que viajan hacia el cátodo, por unidad de tiempo,
normalmente no es tan grande como el número de aniones que van al ánodo, en
el mismo tiempo”. Los datos que dieron lugar a este escrito deberían ser
revisados, pero la muerte de Daniell, cortó el proceso
[8]
.
En marzo de 1845, la Royal Society, celebra un congreso, siendo nombrado Daniell secretario. En dichos trámites, sufre una apoplejía, falleciendo el día 13. Tenía 55 años y un día.
Una vez montada la fuente se dedica a realizar electrólisis
de diferentes sales, cuyos resultados publica
en el Phlosophical Transaction
[6]
. Estos trabajos le valen la concesión de la medalla Copley,
en 1836. En 1840, postula que:
“La fuerza eléctrica que se mide por su acción definida en cualquier punto
de un circuito no puede realizar más de una proporción equivalente de trabajo
en cualquier otro punto del mismo circuito”.
Al realizar la electrólisis
del ácido sulfúrico diluido, del sulfato sódico y del sulfato potásico midiendo
los volúmenes de oxígeno e hidrógeno desprendido, para la misma cantidad de
corriente, concluye que realmente no existe electrólisis del agua, sino del
ácido o de la sal correspondiente. La electrólisis de estas sales fue muy
importante ya que sirvió para determina su fórmula. Veamos como eran las fórmulas
antes y después de estos experimentos electroquímicos
| Sustancia |
Fórmula antigua |
Fórmula electroquímica |
| Sulfato de sosa |
(S+3 O)+(Na+O) |
(S+4 O)+ Na |
| Sulfato de potasa |
(S+3 O)+(K+O) |
(S+4 O)+ K |
| Sulfato de cobre |
(S+3 O)+(Cu+O) |
(S+4 O)+ Cu |

Dibujo de Daniell
NOTAS FINALES
[1] Antes de 1901, fecha del primer premio Nobel, los méritos científicos se valoraban con medallas.
[2] Este instrumento era enorme, no debemos olvidar que la presión atmosférica soporta una columna de agua de cerca de 11 metros de altura
[3] Este barómetro dejó de funcionar, escasas semanas antes de la muerte de Daniell.
[4] Antes, Daniell, empleando el método de Guyton de Mourveau, había dado un valor de 8696ºF, muy lejos de su valor actual 2793ºF.
[5] Este texto fue uno de los más originales que se escribieron en esta época
[6] Todos estos experimentos tuvieron que ser realizados varias veces, pues los primeros datos se perdieron.
[7] Se recuerda que aniones y cationes, nombre propuesto por Faraday, por consejo de Whewell, significan viajeros hacia el ánodo y cátodo, respectivamente.
[8] El problema sería resuelto por Hittorf entre 1853 y 1859.