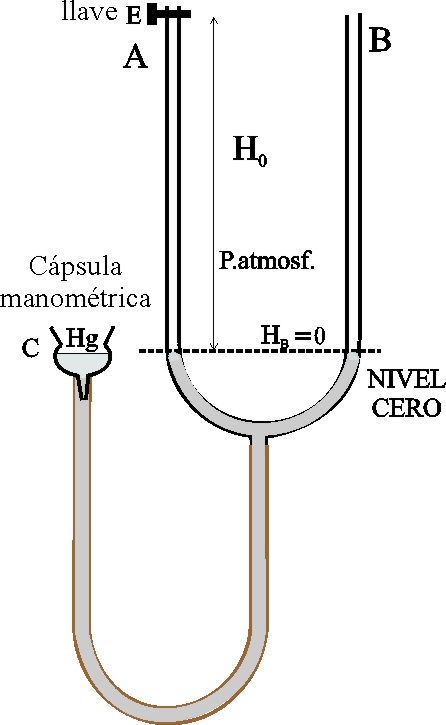
Esquema del montaje inicial
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
LEY
DE BOYLE CON TUBO DE MARIOTTE (práctica individual)
FUNDAMENTO
TEÓRICO Y OBJETIVO DE LA PRÁCTICA
Robert Boyle demostró en 1662 la proporcionalidad inversa
entre la presión que soportaba el aire encerrado en una vejiga, y el volumen
del mismo. No fue una casualidad, sino la extensión de la ley, que su ayudante
Robert Hooke, ocho años más joven que
él, trataba de desarrollar con muelles.
El experimento lo realizó con un aparato diseñado por Roverbal, una bomba
de vacío creada por Hooke, y una idea sugerida por Towneley. Consideró el comportamiento del aire como si
fuera un muelle (“muelle de aire”), ya que tal
como un muelle podía reducir su longitud (elasticidad del aire), al
aplicarle una fuerza de compresión, que sería
inversamente proporcional a la longitud alcanzada por el muelle. F=
K/L (inversión de la ley de Hooke), al dividir ambos términos por la superficie
de la sección de dicho muelle (F/S) = K/LS . Dado que F/S = P (Presión), y
S.L =V(Volumen), la expresión de la ley de Hooke (que se publicaría más tarde)
se reduciría a P= K/V, que resumiría la ley de Boyle. Esta ley sería igualmente
justificada por el francés Mariotte, 15 años después.
Tomando medidas de los diferentes volúmenes de aire encerrado
en un tubo de Mariotte (tubo en forma de U o de J, cerrado en un extremo),
bajo condiciones de presiones distintas, se demostrará la relación lineal
entre P y 1/V. En todo caso la temperatura a la que se efectúa el experimento
se considerará que no varía.
MATERIAL
EMPLEADO
Tubo de Mariotte con llave. Cápsula manométrica. Goma de unión. Mercurio. (papel milimetrado).

Esquema del montaje inicial
REALIZACIÓN DE LA PRÁCTICA
1. El alumno tomará el valor de la presión atmosférica en el aula, anotando su valor.
2. Se llenará con Hg, la cápsula manométrica C, con la llave E abierta(posición vertical), con la cantidad suficiente para que a una altura media, el líquido manométrico alcance el nivel 0 en ambos lados (dado que el Hg es un líquido, que no moja, a diferencia del agua, y forma un menisco convexo, deberá tenerse en cuenta el error de paralaje). Se cierra la llave girándola 90º en sentido horario (conviene que esta operación la realice el profesor).A la presión atmosférica en mmHg, el volumen del gas encerrado en A, será: base x altura = S(sección interior del tubo, aproximadamente 16mm2) x H0. (200mm).
(Véase el esquema y la foto del montaje). Tendremos así los primeros datos que se introducen en la tabla de valores
Primera medida: HA =0, H0-HA
= 200mm, V=200 x 16 mm3, HB =0, HB - HA =0 mm, P = Patm.

Detalle de la foto del montaje (condiciones iniciales)

Foto del montaje
3.
El alumno subirá la cápsula
manométrica hasta una altura aproximadamente de HB
= 40-60 mm, sobre el nivel anterior, fijándola en el soporte, tomando
las alturas del mercurio sobre el nivel 0, en la columna A (que encierra el
gas) : HA y en la columna B : HB , que aumenta la presión
sobre el aire. El volumen del gas en A, será ahora: S x (H0-HA),
mientras que la presión que se ejerce, será P0 en mmHg + (HB
- HA), también en mmHg o torricelli (tor). Los datos se introducirán
como, segunda medida en la tabla.
4.
Sucesivamente irá elevando la cápsula de 20 en 20 mm aproximadamente,
hasta llegar a los 200mm, operando como en el caso anterior con el volumen
del gas encerrado y obteniendo la presión que se ejerce sobre él de la misma
manera. Según el esquema del montaje 1. Se rellenará la tabla con dichos
valores.
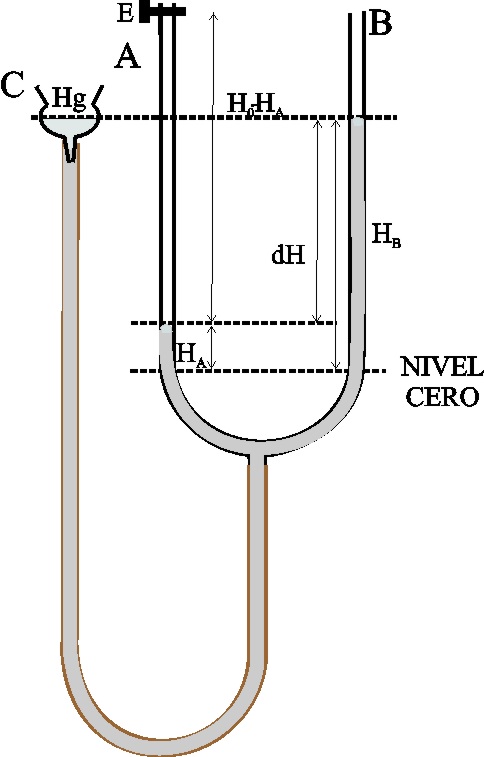
Esquema del montaje ( toma de datos)

Foto de la toma de un dato
TOMA
DE DATOS
| Muestra |
HA/mm |
200-HA/mm |
V/dm3 |
1/V (L-1) |
HB/mm |
HB-HA/mm |
PcmHg |
Patm |
| 1ª |
|
|
|
|
|
|
|
|
| 2ª |
|
|
|
|
|
|
|
|
| 3ª |
|
|
|
|
|
|
|
|
| 4ª |
|
|
|
|
|
|
|
|
| 5ª |
|
|
|
|
|
|
|
|
| 6ª |
|
|
|
|
|
|
|
|
| 7ª |
|
|
|
|
|
|
|
|
| 8ª |
|
|
|
|
|
|
|
|
Gráficas
En
una hoja de cálculo (Excel), se realizará la gráfica P/ atm, frente a 1/V en L-1, obteniéndose
una recta que no debe pasar por el origen. Su pendiente será la constante
de la ley de Boyle: PV= cte.
Nota: Se deberá cuidar especialmente el
estado de la goma y de sus uniones, para evitar pérdidas de mercurio.