
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
El inventado elemento 118
En junio de 1999,
la prensa mundial se hizo eco de un
descubrimiento asombroso, por fin se había sintetizado el tan buscado elemento
118, el último gas noble, el deseado. 15 físicos de la universidad de Berkeley
y de la universidad estatal de Oregón, encabezados por el profesor Ninov,
habían publicado dicho descubrimiento en el Physical Review Letters
[1]
.

Por fin se había
quebrado la supremacía rusa de los últimos descubrimientos de elementos en
los laboratorios de Dubna.
Todo
se había hecho siguiendo las predicciones de un físico polaco Smolanczuk,
que trabajaba con una beca en el laboratorio de Berkeley. Los políticos comenzaron
a hacer declaraciones alabando la superior tecnología norteamericana
[2]
. Pero los resultados no solo no se confirmaron sino que
los datos aportados en la investigación y que pasaron los filtros de las más
prestigiosas revistas, resultaron ser falsos y preparados para obtenerlos
así.
¿Cómo
eran esos datos?
Se
obtenían en una fusión fría al bombardear núcleos de Plomo 208, con Kriptón
86, acelerado en el ciclotrón de resonancia de Berkeley, con una energía de
459 MeV, produciéndose “un solo neutrón”
[3]
y el isótopo del elemento 118 con masa 293.
208Pb82
+ 86Kr36 = 293Uuo118
+ 1n0
El
primer experimento había sido el 12 de abril de 1999, pero solo se habían
conseguido 0,7.1018 iones. En el segundo experimento, a primeros
de mayo, ya lograron 1,6.1018. Los datos incluían unas cadenas
de desintegraciones alfa, con la obtención del elemento 116.
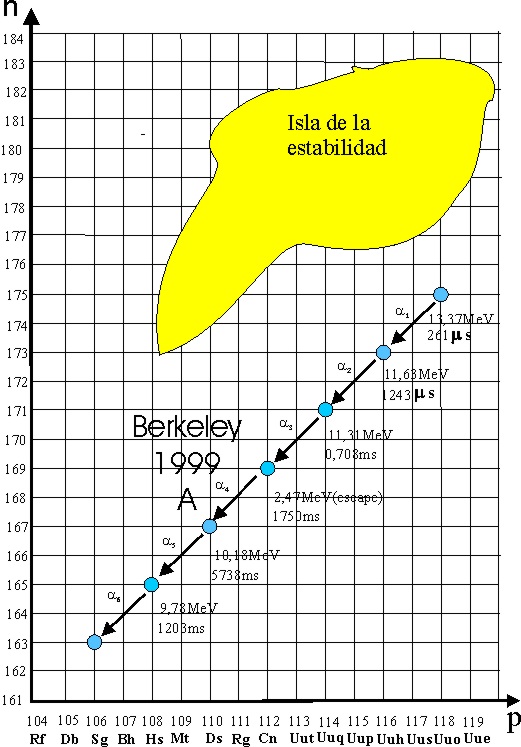
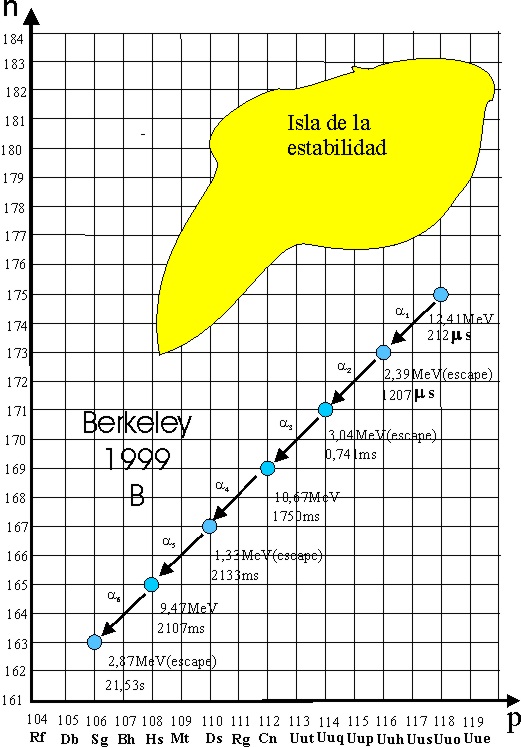
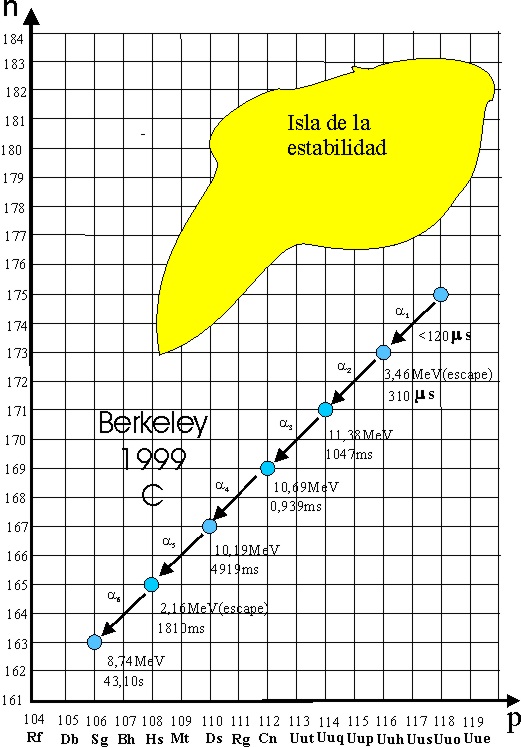
El profesor Ninov,
había trabajado en el GSI de Darmstadt con Hofmann, en la síntesis de los
elementos 110,111 y 112, y por lo tanto
tenía una experiencia acreditada cuando llegó al centro de investigación nuclear de Berkeley. Por eso en este centro
se construyó un separador de gas similar al del GSI. A partir de 1996 trabaja
junto a Gregorich, en el proyecto de obtención de nuevos elementos (116 y
118) a partir de las teorías de Smolaczuk. Los datos obtenidos, basados en
un programa traído del GSI, se mantuvieron en secreto hasta que fueron publicados
y sólo Ninov tuvo capacidad para manipularlos. Sin embargo fueron analizados
por los miembros del equipo, incluidos científicos del GSI, aunque no los
originales, guardados por aquel científico, obsesionado por adelantarse a
los investigadores rusos de Dubna.
La primera comprobación del experimento la hace en
Darmstadt, Hofmann y su equipo, y no detectan las cadenas de desintegración.
Tampoco lo consiguen equipos franceses y japoneses. Al año siguiente, el propio
equipo de Ninov y Gregorich, intentan repetirlo sin éxito. Por todo ello se
deciden comprobar los datos originales,
llegándose a la conclusión que con ellos era imposible deducir las cadenas
de desintegración alfa dadas. Se nombra una comisión de investigación interna
que concluye que se habían introducido datos falsos en el programa. Por fin
en julio de 2001, prácticamente dos años después, se publica en la misma revista
la retractación del descubrimiento, que no se rubricó hasta el año
siguiente
[4]
. El descubrimiento inventado había durando 3 años. Fue
curioso que el equipo norteamericano hasta propuso
en 2002, un nombre para dicho elemento el Ghiorsium, en honor a Albert Ghiorso,
miembro histórico de los equipos de investigación nuclear americanos.
A todo esto el equipo ruso de Dubna, encabezado por
Oganessian, sigue trabajando con un su proyectil milagroso (por su riqueza
neutrónica), el Ca48 y con el sistema
de detección que ya había empleado en el descubrimiento del elemento 114
[5]
, y a finales del año 2000, publican en el Physical Review
C, en colaboración con el laboratorio de Livermore de la universidad de California,
el descubrimiento del elemento 116, obtenido al bombardear
núcleos de curio 248, con el calcio 48. La reacción sería:
248Cm96
+ 48Ca20 = 292Uuo116
+ 41n0
El blanco de curio estaba en forma de CmO2 enriquecido al 96,3%, depositado
en una chapita de titanio de 1,5 micrometros de
espesor. La eficiencia en la separación del 116, se estimó en un 35%. La energía
empleada en los proyectiles de calcio había sido de 240MeV. El resultado obtenido
fue el Uuh 296, con una energía de excitación entre 30,4 y 35,8 MeV, energía
que sería absorbida por la evaporación de 3 o 4 neutrones, en el proceso.
La cadena de desintegración alfa posterior sería la presentada en el dibujo
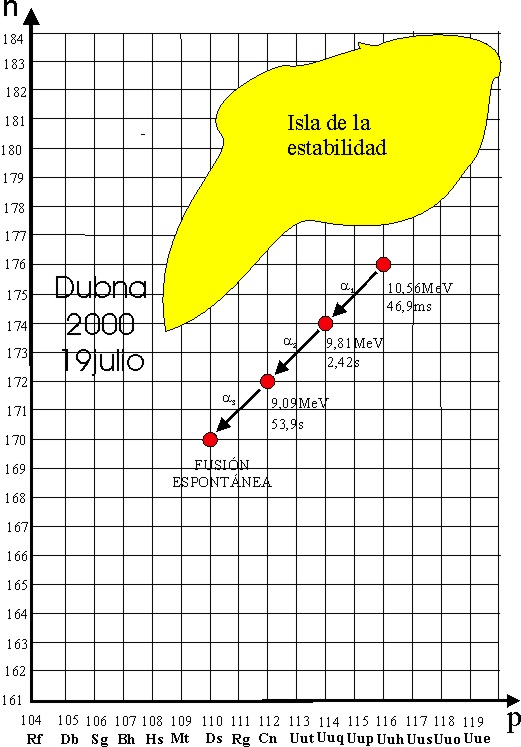
Como se aprecia, ya se estaban acercando
a la isla de la estabilidad, cuyos contornos no estaban todavía bien delimitados
[6]
.
Cuatro
años después el mismo equipo, publica en la misma revista, una revisión del
trabajo realizado en el descubrimiento y obtención de los elementos 112,114
y 116. Pero ¿y el 118, que prematuramente había sido inventado?
El equipo ruso-norteamericano
de Dubna-Livermore, lo estaba intentando desde el 2002, a través del bombardeo
de californio con calcio 48, se obtendría un núcleo del elemento 118, con
una energía de excitación de 29 MeV, y 4 neutrones que la absorberían. Se
emplearon blancos de CfO2, con una riqueza del 98%, insertado en una placa
de titanio. Las sesiones experimentales
duraron de 2300 horas, y se acumularon 2,5.1019 iones. La reacciones
serían las siguientes:
248Cf98
+ 48Ca20 = 294Uuo118
+ 41n0
248Cm96
+ 48Ca20 = 291Uuo116
+ 51n0
Durante los años
siguientes dicho equipo estuvo comprobando el experimento, después de los
precedentes habidos.
Por fin este
equipo, anuncia el 10 de octubre de 2006
[7]
, la síntesis de 3 átomos del elemento 118. Las cadenas
de desintegraciones alfa de los elemento
116 y 118, presentados son las siguientes:
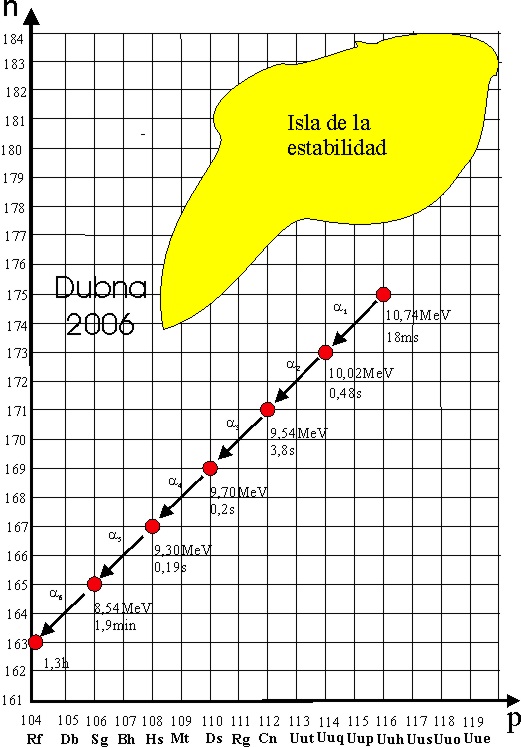
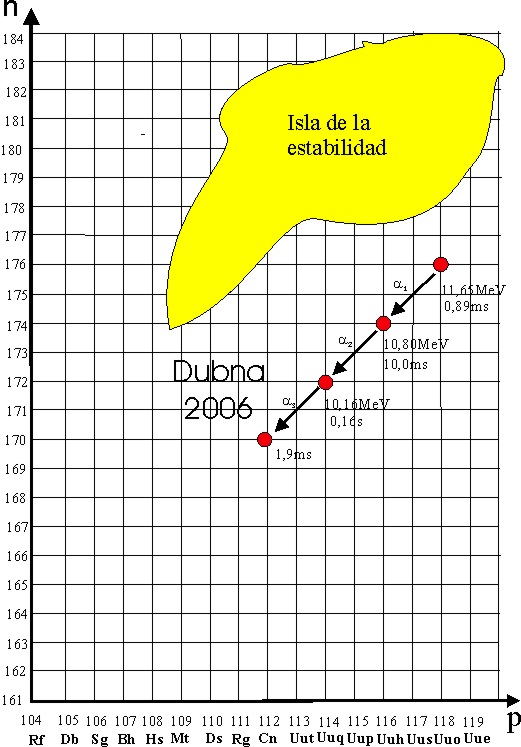
Los científicos
rusos proponen un nombre para el elemento: el flyorium, en honor al físico
ruso Fliorov, padre de la investigación nuclear en dicho país. También se
propuso el de moskovio, por Moscú,
donde se encuentran los laboratorios de Dubna. Se espera que la comisión
mundial para las propuestas de nombre de elementos químicos decida en breve,
prevaleciendo el derecho de los equipos de Dubna y Livermore.
¿Cómo debería
ser el elemento 118? En la periodicidad
química sería eka-radón, y por lo tanto un gas noble. Sin embargo las predicciones
indican que ni sería gas, ni tampoco noble. Se presuponen combinaciones
con el flúor, en forma de UuoF4, con estructura tetraédrica y
el UuoF2 .Por extrapolación su punto de ebullición estaría entre
320 y 380K, por lo tanto no sería gas en condiciones estándar.
[1] En 1999, aparecieron 3 publicaciones casi sucesivas. Dos teóricas de Robert Smolanczuk, sobre predicciones para la obtención de elementos superpesados, en julio y en noviembre en el Physical Review C, y la de Ninov, en el Physical Review Letters de 9 de agosto. Había sido recibida por la revista el 27 de mayo, y enseguida, por su importancia se filtró a la prensa.
[2] Las declaraciones de los políticos de turno fueron muy curiosas. Según el secretario de energía norteamericano Bill Richardson:”Este sorprendente descubrimiento abre una puerta a una investigación mas profunda de la estrucrura de los núcleos atómicos”. Derleane Hoffman, miembro del equipo de Ninov, declararía: “Después de 30 años de investigación el descubrimiento es muy gratificante. Sólo hubiera deseado que Glenn Seaborg estuviera vivo para ver estos resultados. El propio Ninov escribió: “Hemos saltado desde el mar de la inestabilidad a la isla de la estabilidad”.
[3] Parece difícil que la emisión de un sólo neutrón consiguiera enfriar el proceso. Hasta la fecha no se había conseguido.
[4] Este fraude provocó la revisión de los trabajos en los que había intervenido Ninov en Darmstadt, sobre el descubrimiento de los elementos 110,111 y 112.
[5] Véase “El deseado elemento 114” en esta misma web.
[6] Se suponía que el límite de la isla de estabilidad, estaba en la zona de los 184 neutrones.
[7] La publicación en el Physical Review C, se presentó en enero del 2006. Pero con los antecedentes habidos en las publicaciones de la revista, el manuscrito fue revisado en agosto, para ser publicado en octubre. Antes había aparecido otra publicación en Pure Appl.Chem, del mes de agosto del mismo año.