ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Los otros hijos del uranio: Actinio y Radón
Otros dos elementos, esta vez no
metálicos, van a surgir en las investigaciones radiactivas. En 1899, Andrés Debierne, que más tarde habría de descubrir
la radiación gamma, en una fracción de la pechblenda que contenía el hierro
precipitado, aísla un elemento parecido al titanio por su comportamiento
químico, con una actividad cien mil veces superior a la del uranio y que
por ello llama ACTINIUM, derivado del griego ACTINOS (αχτιvoς,
rayo). Con ello, tanto éste como el RADIUM tienen el mismo significado
en los dos idiomas básicos, griego aquél, latín éste. Sin embargo, lo que
descubrió Debierne, no era sino una mezcla de compuestos radiactivos, porque
la emisión captada era alfa, y el elemento en cuestión es beta emisor y
por lo tanto, mucho más difícil de detectar por su pequeña capacidad ionizante.
Quiere decir que dicho nombre no se debería atribuir a
tal elemento.
Poco tiempo después, en 1902, el
químico alemán Friedrick Giesel, partiendo de la pechblenda, en una fracción
con analítica similar a las tierras raras, después de separar el lantano
y el cerio, obtiene una fracción con especial radiactividad. De ella "emana" un gas que provoca fluorescencia
en una pantalla de sulfuro de cinc, característica de los emisores alfa.
Al elemento químico responsable, que incluso identifica espectroscópicamente,
lo denomina EMANIUM, que corresponderá al ACTI-NIUM descubierto
por Debierne, cuyo nombre permanecerá, pero no con el ACTINIUM actual,
que hemos dicho es beta emisor, hecho que sólo se detectó 35 años después.
Tenemos dos nombres más puestos indebidamente para un elemento que todavía
no estaba descubierto; era lógico. Realmente el actinio es muy poco abundante;
2500 veces menos que el radio. Sin embargo, en función de su separación
analítica, enseguida se situó en el sistema periódico de Mendeléev; en 1906,
el inglés Cameron
[1]
lo colocó en el grupo 31, más o menos como se encuentra
en la actualidad.
Curiosamente el elemento ACTINIUM
ya existía antes, nada menos que desde 1881, descubierto por Tomás Phipson,
referido a una sustancia que coprecipitaba en tierras que contenían plomo,
hierro, manganeso y cinc, junto con el sulfato de bario y de cinc, y que
aparecía con unas propiedades especiales que le hacían cambiar de color,
de blanco a negro, en pocos minutos a consecuencia de su radiación, por
eso al elemento que contenía lo llamó así. Incluso llegó a aislar el óxido
y el sulfuro de actinio, con propiedades muy parecidas a las del cinc, y
finalmente separa el metal precipitándolo en solución amoniacal con magnesio.
Toda esta investigación fue publicada en el Chemical Review de 1881 y 82;
sin embargo este descubrimiento no tuvo importancia ni fue corroborado.
Unos años más tarde, en 1905, una vez homologado el ACTINIUM,
el mismo Giessel junto con su colaborador Godlewski, aísla en la misma fracción
una sustancia que precipita junto con el
hidróxido férrico al añadir carbonato amónico a la que contenía el actinio y el hierro. Presenta
una fuerte actividad, y siguiendo la moda impuesta por Crookes de seudoadjetivar
a los nuevos elementos extraídos de la fracción donde se encontraba otro
ya bautizado, con letras de incógnitas, lo denominan ACTINIUM X.
Al año siguiente, Hahn descubre el RADIO-ACTINIUM, más tarde se completaría
la familia del Actinio.
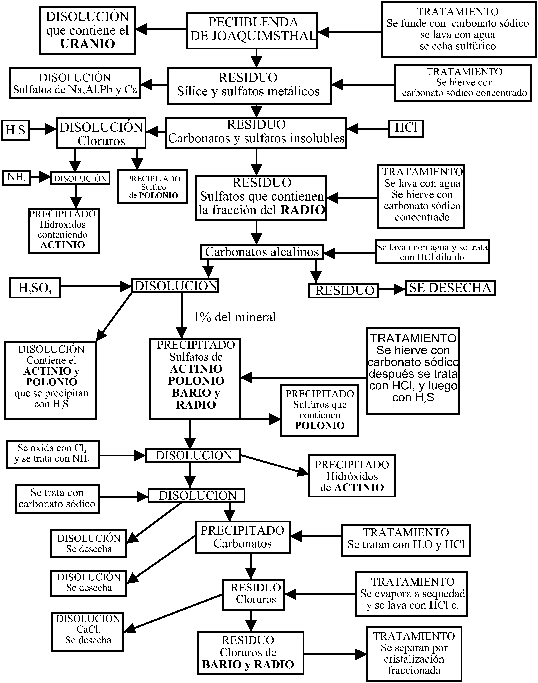
La marcha analítica que permitió
el aislamiento de los tres nuevos elementos a partir de la pechblenda sería
la siguiente:

Las diferentes fracciones que surgen
en la marcha analítica de la pechblenda fueron estudiadas por la mayoría
de los científicos europeos, puesto que los Curie se mostraron extraordinariamente
generosos en su investigación. En 1900, Crookes, en la fracción del uranio
precipitada junto con el hierro como hidróxido, y separada de aquél, encuentra
una sustancia mucho más activa que denomina URANIUM X o UrX
[2]
, por proceder del uranio y ser desconocida.
De esta fracción se separan otras dos sustancias de diferente actividad;
en 1907 se denominaban URANIUM 1 y URANIUM 2, que después
serían el URANIUM X1 y URANIUM X2. El primero se desintegraba
formando un compuesto de muy corta vida y gran actividad, estudiado por Casimiro Fajans y Göhring,
que lo bautiza en 1911 como BREVIUM
[3]
, y que va a ser el propio URANIUM X2,
todos ellos beta emisores. También en ese año, el profesor Antonoff, del
equipo de Rutherford, descubre el URANIUM Y2, y posteriormente, Hahn,
del mismo equipo, el URANIUM Z. Tenemos nada menos que 9 hijos del
uranio.
En 1900, Federico Ernesto Dorn,
basándose en una observación de los Curie, que habían mencionado que el
aire que rodeaba a los compuestos radiactivos se volvía a su vez radiactivo;
descubre que este hecho era debido a que el radio al desintegrarse emitía
un gas. Lo llama NITÓN (nombre propuesto por Ramsay, derivado del
netere latino con el significado "el que brilla"
[4]
) o EMANACIÓN DEL RADIUM.
El equipo
de Rutherford de la universidad McGill
[5]
de Montreal (Canadá), trabaja con los productos
de la fracción del radio. Así su ayudante Enriqueta Brooks descubre en 1904,
que en todas las sustancias expuestas al radio emanación, surge una película
superficial sumamente activa. En ella se aísla el RADIUM A, B y C.
Rutherford propone estos nombres, en contra de la tendencia de emplear las
últimas letras, porque ya había usado las primeras letras griegas para denominar
las partículas de emisión radiactiva descubiertas por él a finales de siglo.
Su equipo, formado por Geiger y Marsden y después Hahn, ya en Manchester,
completa la investigación descubriendo entre 1909 y 1911, los RADIUM
C', C'', D, E y F, que se identificará con el polonio, y por
fin el RADIUM G. Sin embargo el radio no se producía directamente
a partir del uranio, como cabría esperar, aunque aparecieran juntos en la
pechblenda. La búsqueda del eslabón perdido duró tres años.
Al fin en 1907, independientemente
Boltwood, Hahn y Marckland, lo descubren. El primero lo bautiza por su poder
ionizante, y puesto que todavía no se había empleado esta propiedad para
nombrar a un elemento radiactivo, como IONIUM
[6]
(Io). El IONIUM se
convertirá en radio, con un período de semidesintegración de casi cien mil
años. De esta forma, los hijos del ionio integran aparte de los conocidos
radio y radio emanación, otros nueve hermanos; los radios alfabéticos. Por
otra parte el ionio, era hijo de un uranio, con lo cual las dos familias,
uranio y radio, estaban emparentadas, formando una única, de nada menos
que 15 miembros
[7]
.
También se producían gases en la desintegración
del torio y del actinio, recibiendo respectivamente los nombres de EMANACIÓN
DEL THORIUM (EmTh), descubierta por Rutherford en 1900, en la universidad
McGill de Montreal (Canadá), y EMANACIÓN DEL ACTINIUM (EmAc), por
Giessel en 1902. Al invertir los tres nombres abreviándolos quedó RADÓN
(Rn), TORÓN (Tn) y ACTINÓN (An), tres nombres para los
que después serían tres isótopos del mismo elemento. Para evitar confusiones
se propuso el nombre de EMANÓN que no fue homologado (ya existía
el emanium), por ello en la práctica se sigue usando el procedente del descubridor,
esto es el RADÓN, con símbolo Rn.
Las tres variantes de gas emitido
se forman en desintegraciones diferentes, siempre emitiendo partículas α,
con períodos de desintegración respectivos de 4 días, un minuto y 4 segundos
[8]
. Así el primero sería a partir de U238, el
segundo del torio 232, y el tercero del uranio 235, según las siguientes
reacciones nucleares:
238U92
= 222Rn86 + 4α + 2β
232Th90 = 220Tn92
+ 3α + 2β
235U92 = 219An86 + 4α +
2β
En 1910, el elemento, que resultaba
ser un nuevo gas noble, el que faltaba, fue determinado por Ramsay, tanto
su densidad como su peso atómico encajaban perfectamente en el lugar previsto.
Era el sexto gas noble, que tampoco eran tan noble puesto que tenía una
vida de 4 días, pero suficiente para formar compuestos conocidos.
La serie del actinio no estaba
completa, naturalmente el hecho de que surgieran beta emisores hacía mucho
más difícil su identificación. Más tarde se tratará de ella a partir del
descubrimiento de otros nuevos elementos.
Aunque no tenían relación con la
pechblenda, también los minerales de Thorium demostraban actividad radiactiva,
como había demostrado el alemán Schmidt poco antes del descubrimiento del
Polonio por los Curie. Al año siguiente Rutherford
[9]
y Soddy en Montreal, aíslan el THORIUM X
(ThX) y después el TORÓN
[10]
. Se agrupan estos nuevos "elementos"
en familias y se intenta conexionarlos dentro de cada familia. El sistema
de investigación lo habían iniciado los Curie. Se estudia una marcha analítica
en los minerales que contienen torio de diferentes procedencias, se observa
que en muchas fracciones aparece más actividad que en la partida inicial,
se infiere que debe contener otro elemento radiactivo, y se busca cómo aislarlo.
Esa idea aplicada por Boltwood, hizo que en 1905 Hahn descubriera
RADIO-THORIUM (RdTh) y después el MESOTHORIUM (MsTh),
que fueron posteriormente dos: los MESO-THORIUM I (MsTh1) y II
(MsTh2), descubiertos por Otto Hahn
[11]
y Lise Meitner. El THORIUM A (ThA),
sugerido por Rutherford en la descomposición del TORÓN, será descubierto
por Geiger y Marsden, los mismos que realizaron la experiencia diseñada
por Rutherford de dispersión de partículas alfa por átomos de oro. A su
vez el THORIUM A se desintegraba sucesivamente, tal como ocurría
en otras familias, en otros THORIOS, que recibirían sucesivamente
los nombres de B, C, C= y C=>. Algunos de estos elementos radiactivos
ya se habían identificado antes por Rutherford, pero la serie no se completó
hasta después.
Naturalmente todos estos elementos
no eran nuevos metales, pues se manifestaban químicamente indistinguibles
de otros ya identificados y nombrados. En un período de diez años, surgieron
hasta cuarenta, aparecerán símbolos químicos con hasta cinco caracteres, organizando enormes
problemas a nivel de formulación de sales y compuestos de los nuevos elementos.
Sin embargo, su nomenclatura diferenciada
durará muy poco, sólo hasta que Soddy introduce el concepto de ISÓTOPO
[12]
en 1913, con el cual el An y el Tn serán el
mismo Rn Por ello los elementos que surgían en las desintegraciones
correspondían a isótopos de otros elementos conocidos. Este hecho tardó
todavía algunos años en admitirse.
[1]
Cameron fue el inventor del
término radioquímica para la nueva ciencia que tanta importancia tuvo
en la medicina, y que le valió el segundo Nobel, en 1911, a María Curie.
[2]
Él mismo publica en su revista Chemica News, el 1 y
8 de junio de 1900, el descubrimiento, haciendo constar que: "Para
entendernos mejor es preciso que el nuevo cuerpo tenga un nombre. Hasta
que sea más asequible le llamaré provisionalmente UrX".
[3]
El BREVIUM va a ser el EKA TANTALIUM
previsto por Mendeléev en 1871, con peso atómico aproximado de 235 unidades,
situado entre el torio y el uranio, y que debería actuar con valencia
5, formando óxidos Et2O5.
[4]
El NITÓN deriva del netere latino,
que hace referencia al brillo de
las joyas y se empleó con asimilación de la emisión de luz característica
de los compuestos radiactivos, tal como en las otras ideas desarrolladas.
Deriva de la raíz indoeuropea *nei, que dará el irlandés niam (lustrar)
o el galés nwyf (vivacidad).
[5]
La universidad McGill, a la
que fue Rutherford, el 8 de septiembre
de 1898, en el trasatlántico AYorkshire@, para poner en
marcha el Instituto Físico, estaba financiada por el millonario canadiense
McDonald, que había conseguido su fortuna a través de plantaciones de tabaco, y que sin embargo tenía
prohibido fumar en todas las instalaciones
y alrededores de Asu universidad@. Allí creó sus
primeros equipos de investigación. Aparte de él, tres de los investigadores
que formó, en Monreal, Manchester y Cambridge recibieron el Nobel de Química
(Soddy, 1921; Aston 1922; Hahn, 1944).
[6]
El IONIUM que acuñó Boltwood
(pocos años antes había bautizado así Crookes a otro seudo metal), tomó
el nombre de la ionización del aire, que a su vez lo hace del término
ión, propuesto por Faraday, bajo el asesoramiento de Whewell, para los
fragmentos de materia con carga eléctrica que "caminaban" hacia
los electrodos. Ion, Çov o Çωv, forma
del verbo griego είμι
ir, significa el que va, el
caminante o viajero. Deriva
de la raíz indoeuropea *ei o *ya, por eso en avéstico es ya, y en viejo
inglés eode, padres del go actual y por eso, nuestro ir, derivado del
latino ire, se parece tanto al letón iet, al checoslovaco iti, al serbocroata
ici, al bohemio jiti, y al védico aitiy.
[7]
La transmutación radiactiva,
con emisión de partículas y producción de nuevos elementos, fue inicialmente
propuesta por Pedro Curie el 14/06/1900 en la Sociedad de Socorros de
los amigos de las Ciencias de París, dos años antes que Rutherford y Soddy
la desarrollaran en Montreal.
[8]
El problema de la producción
de elementos gaseosos radiactivos era la Aexpansividad@, que impedía la
correcta medida de su actividad, por eso había que tener especial cuidado
en impedir que se escaparan. En algunos casos invadían otros laboratorios,
haciendo que en éstos aparecieran falsos productos radiactivos, lo cual
proporcionó gran cantidad de anécdotas e historias "radiactivas".
[9]
Desde el primer libro sobre Radiactividad, en 1904,
hasta el último "La nueva alquimia" de 1937, meses antes de
morir al estrangulársele una hernia, su vida estuvo dedicada al estudio
de las radiaciones y los radioisótopos. Bautizó la partícula alfa y la
beta, el protón y el protón neutro que Harkins llamaría neutrón, y recibió
el Nobel en 1908, por su contribución al estudio de
estas radiaciones. Soddy, el primer gran colaborador de Rutherford,
que tendría una cátedra propia en Glasgow, cuando éste regresó a Manchester,
va a escribir el famoso primer libro de los compuestos radiactivos, en
1911, con el título de ALa química de los
radioelementos@. En él aparecen frases claves como: @La química del
ionio puede explicarse completa y exactamente con una frase: es idéntica
a la del torio, de tal forma que los dos elementos no pueden separarse
por ningún procedimiento conocido@. En otra página,
indica: @La química del mesotorio I se
resume en: Es idéntica a la del radio de modo que no puede separarse de
éste último@. En el segundo
tomo de su libro, ya aparece el nombre de isótopos para estos elementos
inseparables, que reducirá el número de los elementos nuevos encontrados
desde 40 hasta 7. Precisamente Soddy obtuvo el Nobel de Química por su
contribución al desarrollo de la química del mesotorio 2.
[10]
Realmente el descubrimiento
del torón se debe a Owens, que en 1899 observó que la corriente debida
a la ionización del aire que rodeaba a un mineral de torio, se reducía
rápidamente al hacer vacío.
[11]
Existe una conocida anécdota
contada por Werner Braunbeck en un recuerdo a Otto Hahn, que relata que
cuando éste fue movilizado en el primer año de la primera guerra mundial,
con el grado de teniente, al ser presentado a un alto oficial alemán como
Adescubridor del
mesotorio@, éste le contestó:
A)Cómo?, Yo creía
que el teniente Hahn era químico, )Qué tiene él que
ver con los animales antediluvianos?@. Era evidente
la confusión de mesotorio con megaterio.
[12]
Antes de este concepto
se usaron otros. Rutherford y Soddy emplearon en Montreal el término
metabolón. En 1902, el inglés Martin ya usó el de radio elemento,
una vez que Curie introdujo el concepto de radiactividad. Por fin Soddy
fijó el de isótopo, tal como se conoce en la actualidad. El griego τόπoς,
topos, hace referencia a posición o situación, y tiene un origen etimológico
oscuro vinculado con el letón tapt, y el lituano tapti, situarse, posicionarse,
que dará el gótico staps. Posiblemente sea la raíz
indoeuropea *sta, que dará el inglés
stand, puesto, sitio, el origen común de todos estos términos, así aparece
en sánscrito como sthana y sthala, a través de la derivación *stel, que
también producirá el viejo germánico stellan.