ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
FORMULACIÓN
ESTRUCTURAL INORGÁNICA (CONTINUACIÓN)
6. SALES NEUTRAS Y ÁCIDAS
DE HIDRÁCIDOS
6.1. SALES NEUTRAS.
Las sales
tienen fundamentalmente estructuras iónicas sólidas, y por lo tanto para ellas
no deben darse fórmulas moleculares. Las que se mencionan corresponden a agrupaciones
en estado gaseoso o en estado líquido en interacción con el disolvente.
Dado que estas
sales no tienen oxígeno, inicialmente, se sitúa el elemento central, esto
es, aquel que se rodea de un mayor número de átomos o grupos, y que en algunos
casos puede nominar la molécula. Si actúa con valencia iónica negativa, a
la hora de la distribución del espacio electrónico se deberá tener muy en
cuenta los pares electrónicos no compartidos de este elemento. Así mismo existen
determinadas anomalías, como la tendencia a formar moléculas dímeras, y
iones dímeros que van a modificar la geometría molecular.

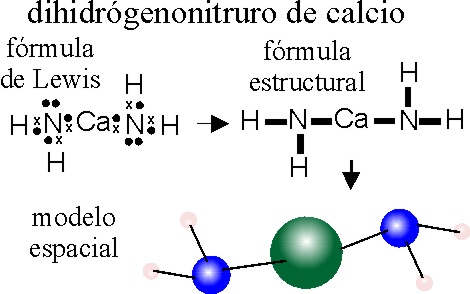
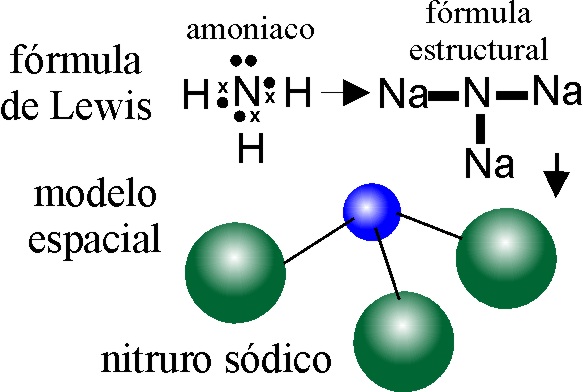
EJEMPLO 28: NITRURO SÓDICO
PASO 1: Se escribe sólo el símbolo del N (con valencia 3-)
PASO 2:
Se rodea de 3 Na, que se unen directamente al N
OBSERVACIÓN:
Aunque en el plano la geometría de la molécula es triangular, realmente en
el espacio no lo es, pues el N s2p3, va a disponer sus
5 electrones de valencia en 4 orbitales híbridos sp3
, dando lugar a una estructura tetraédrica con un par electrones no
compartido .Por ese motivo el ángulo de enlace no es de 120 grados sino de
109,5 (tetraédrico) que al distorsionarse por la acción del par no ligante,
se desvía hasta casi 107 grados.
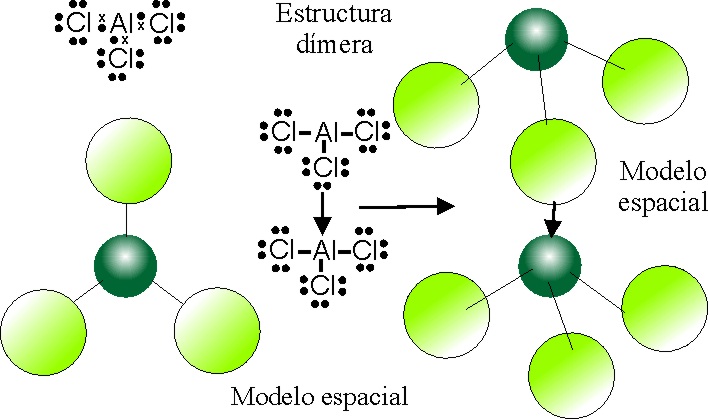
PASO 1:
Como en la fórmula empírica el aluminio se combina con 3 Cl, disponemos
aquél elemento como central.
PASO 2:
Se distribuyen los 3 Cl, lo más separadamente posible.
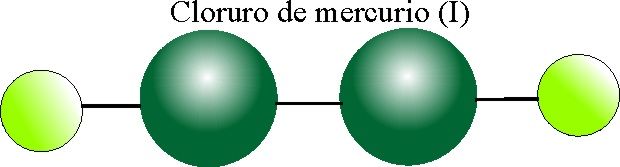
PASO 1:
Dado que el ion mercurioso es dímero -Hg-Hg-
(anómalo),se dispone como central.
PASO 2:
Se unen los
2 cloros al central: Cl-Hg-Hg-Cl, produciendo en la molécula dímera una estructura
lineal.
6.2. SALES ÁCIDAS
En este tipo
de sales, las valencias del elemento negativo, se saturan con los hidrógenos
indicados en el nombre, de forma que sólo las libres se emplean para unirse
al metal.
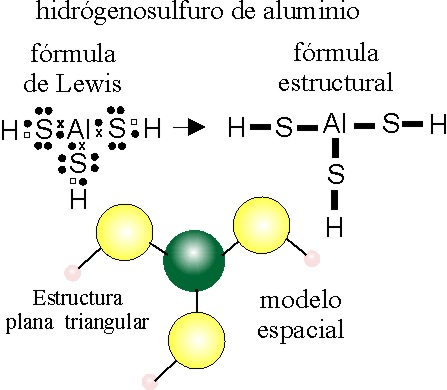
PASO 1:
Se escribe
el ion hidrógeno sulfuro, al saturar una de las valencias del -S- , con H,
formando el H-S- con una valencia.
PASO 2:
Como el Al tiene valencia
3, deberá rodearse de 3 -S-H, dispuestos lo más separadamente posible, en
una estructura triangular, con ángulos S-Al-S de 120 grados.
PASO 1:
PASO 2:
Dado que el -Ca- , tiene valencia 2, se saturarán con dos grupos dihidrógeno nitruro, proporcionando una disposición lineal N-Ca-N.
OBSERVACIÓN: El ion dihidrógeno nitruro, es tetraédrico, debido al par no compartido que tiene el nitrógeno, por eso el ángulo de enlace H-N-Ca, no es de 120 grados como pudiera parecerlo al escribir la fórmula en el papel, sino de aproximadamente 107.
7. SALES NEUTRAS Y
ÁCIDAS DE OXOÁCIDOS.
7.1. SALES NEUTRAS.
Las estructuras
sólidas de estas sales corresponden a compuestos iónicos, y por lo tanto se
mantiene lo expuesto anteriormente (6.1),para estos
casos. La formulación estructural implica que antes se dispuso de la empírica
correspondiente, que nos servirá de referencia dado que es el resumen de aquella.
Por lo tanto partirá de la estructura del oxoácido "progenitor",tal
como se ha expuesto en el apartado 2.
.jpg)
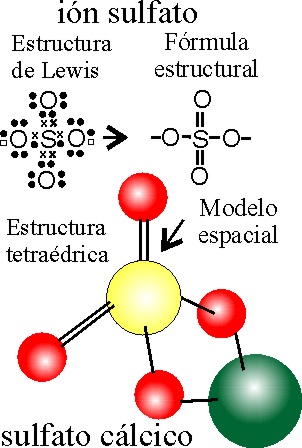
PASO 1: Se formula el ácido sulfúrico como en el ejemplo 1.
PASO 2: Se
extraen los H, disponiendo el tretraoxo-sulfato(VI),de
dos valencias libres.
PASO 3: Se
saturan estas valencias libres con el metal, teniendo en cuenta el principio
de la electroneutralidad. En este caso el calcio, complementa perfectamente a un sulfato.
OBSERVACIÓN:
Dado que los 4 O se disponen en los vértices de un tetraedro con centro en
el S, la agrupación con el Ca, será tridimensional.
PASO1:
Se
parte del ácido sulfúrico(Ej1), se extraen 2H, lo que implicará dos
puntos de unión con el Fe
PASO 2:
Como
el Fe tiene valencia 3, son necesarios 2Fe (en el modelo espacial, como bolas
verdes) para combinarse con 3sulfatos
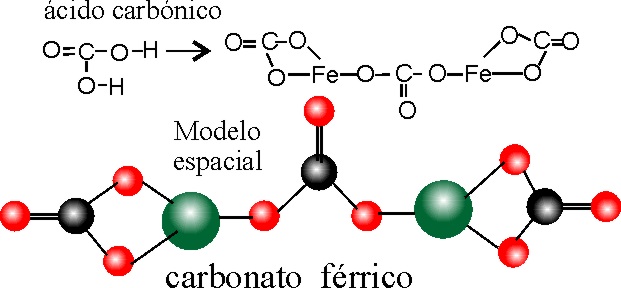
PASO 1: Se formula el ácido carbónico como en el ejemplo 2.
PASO 3: Como el Fe tiene valencia 3 (dispone de 3 cargas positivas),se nece-sitarán 2 Fe para neutralizar a 3 carbo-natos, lo cual a efectos estructurales implicará que los 2 Fe combinarán sus 6 valencias, con la que le queda libre a los 6 O de los 3 carbonatos. La disposición espacial implicará que un carbonato actúa de puente entre los dos Fe.
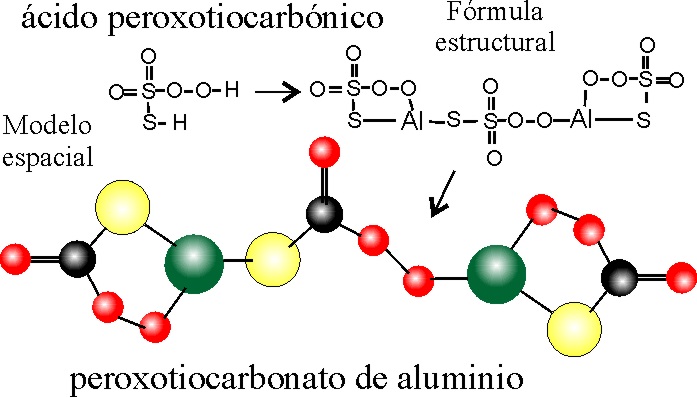
PASO
1: Se escribe el ácido CARBÓNICO .
PASO 2: Se sustituye un-O- por un peroxo-O-O- .
PASO 3: Se
reemplaza un -O- por un tio -S- .
PASO
4: Se extraen los H, formando el anión
dioxoperoxo-tiosulfato(VI).
PASO
5: Como el aluminio tiene valencia 3 y el anión 2, la electroneutralidad exige
la disposición de 3 grupos aniónicos 2, frente a 2 catióniócos Al, 3+, lo cual
a efecto de uniones estructurales implica que un grupo aniónico actúe como
puente entre 2 Al.
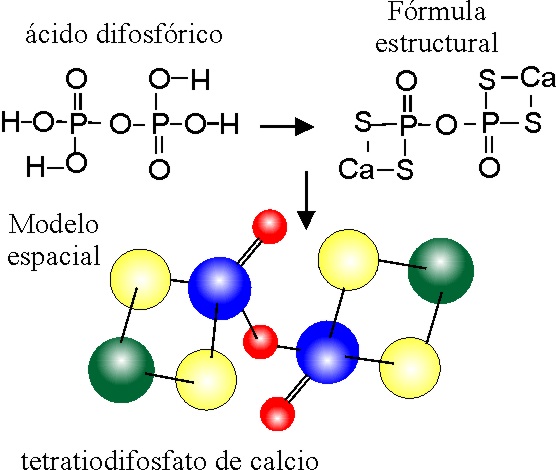
PASO 1:
Se escribe el ácido difosfórico como en el ejemplo 8 ( P azul en el modelo espacial).
PASO 2:
Se sustituyen 4 oxos –O-) por 4 tios (-S-) ( amarillo en el modelo espacial
PASO 3:
Se extraen los H, quedando
sin saturar las 4 valencias de los grupos tio S, a efectos estructurales,
que se tendrán que saturar con el calcio. El anión formado sería el tetratiodifosfato
con 4-.
PASO 4:
La neutralidad eléctrica implica que saturen a 2 Ca 2+, (verde en el modelo espacial) lo cual a efectos de formulación estructural provocará que cada calcio se una a dos S.