ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
FORMULACIÓN ESTRUCTURAL
INORGÁNICA I ( Simbología química 9)
1. INTRODUCCIÓN.
Del mismo
modo que estamos acostumbrados a escribir las fórmulas en Química Orgánica
de una manera estructural puesto que dichas fórmulas nos aclaran mucho mejor
la verdadera forma de la molécula orgánica, nos indican los enlaces que existen
entre los átomos y son un paso importante
y necesario para llegar a una fórmula espacial orbital, verdadera radiografía
electrónica de la molécula, deberíamos habituarnos a hacer lo mismo con las
fórmulas inorgánicas, que nos permitirán comprender mejor el mecanismo de
sus reacciones; no olvidemos que desde Butlerow ya en 1874 existen las fórmulas estructurales, y que cada
raya, según representó por primera vez Couper, en 1858, significa una unión
química.
La mejor manera
de llegar a las fórmulas estructurales, es a través de las nomenclaturas recomendadas
por la I.U.P.A.C.en 1970, fundamentalmente el llamado sistema STOCK desarrollado en esta
web con anterioridad, puesto que se basa en el principio de construcción,
en el cual el elemento central da nombre al compuesto, y los que le rodean,
ligandos, lo hacen de forma que se estorben lo menos posible. Sin embargo
hemos de tener en cuenta que la teoría que se propone está adaptada al nivel
de Bachillerato y que por lo tanto prescinde de enlaces como el coordinado
que se establece en muchas moléculas de oxoácidos,
no contempla la posibilidad de modificación de estructuras por formas
resonantes y da una visión muchas veces simplificadora de
compuestos con configuraciones y geometría bastante complicada.
La relación
entre las fórmulas STOCK, y la teoría
del octeto de Lewis y Langmuir, parece evidente ya que una raya de enlace
indica un par de electrones compartido. Por otra parte desde 1940, con los
trabajos de Sidwick y Powell, que complementan las teorías de enlace anteriores,
sabemos que los pares de electrones deben rodear completamente al elemento
central. Así moléculas tales como el CCl4, los 4 pares de electrones
deberán disponerse tetraédricamente, y los 5 pares compartidos del PF5,
tendría que disponerse en forma de bipirámide trigonal, ampliándose el octeto
en este caso a un deceto. La explicación simplificatoria, que escapa de las
complicaciones de la hibridación de los orbitales atómicos y de la teoría
de orbitales moleculares (TOM), surge en 1957, con el trabajo de Gillespie
y Nyholm, sobre estereoquímica inorgánica, donde se pone el punto de salida
a la teoría de repulsión del par de electrones del nivel de valencia (VESPR)
[1]
, que justificará geométricamente la disposición de los
ligandos alrededor del elemento central. Esta teoría servirá de base para
el desarrollo de otra teoría mas refinada en
el uso de la geometría espacial; la del empaquetamiento cerrado de ligandos
(LCP)
[2]
, a finales del siglo XX. De la que se hará uso a lo largo
de este tema en la disposición espacial de los ligandos alrededor de un átomo
central, así como de los ángulos de enlace experimentales.
Pasos a dar
para construir su molécula:
PASO
1: Se dispone el elemento central que da nombre al compuesto, de tal forma
que se rodee lo más simétricamente posible de tantos grupos oxo [ -O- ], como
indique el nombre; en este caso 4 [TETRAOXO].Dichos grupos debido a su densidad
electrónica, deberán estar lo más separados posible, para reducir la repulsión
culombiana y aumentar su estabilidad. En el plano del encerado la disposición
normal sería en los vértices de un cuadrado en cuyo centro se dispusiera el
S, sin embargo como dicha molécula es tridimensional, la disposición más real
sería según los vértices de un tetraedro más o menos distorsionado.
PASO 2: Se mantendrán tantas uniones entre el elemento
central [ S ],y los oxígenos como ligandos, como indique la valencia de aquél,
con lo cual las 6 del S, se repartirán entre los 4 O, correspondiéndole a
2 oxígenos una unión doble, S=O.
PASO 3: Los oxígenos que no saturen sus valencias,
se unirán a los hidrógenos, no pudiendo quedar ni valencias libres, ni elementos
combinados con valencia diferente a la que tienen al formar el compuesto.
La
geometría es tetraédrica ligeramente distorsionada, tal como se observa en
la figura
2. FORMULACIÓN ESTRUCTURAL
DE OXOÁCIDOS.
2.1. OXOÁCIDOS
GENERALES CON UN ÁTOMO CENTRAL.
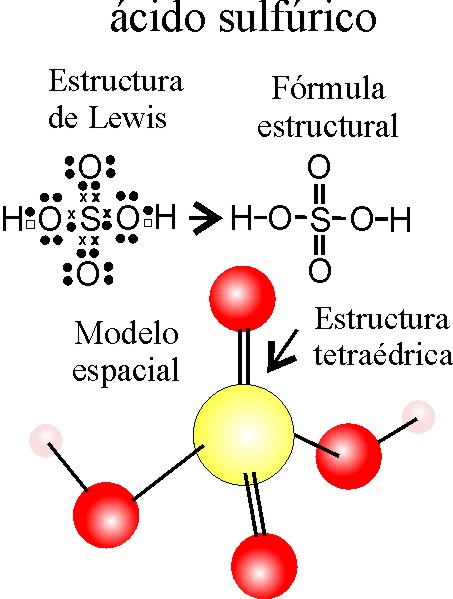
EJEMPLO
1. FÓRMULA ESTRUCTURAL DEL ÁCIDO
SULFÚRICO.
El ácido sulfúrico
en las diferentes nomenclaturas de la IUPAC, sería: TETRAOXOSULFATO DE DIHIDRÓGENO
(prefijos o estequiométrica), TETRAOXOSULFATO(VI) DE HIDRÓGENO
o incluso ÁCIDO TETRAOXOSULFÚRICO(VI) (Stock). Es evidente que la Stock,
al informarnos de la valencia con que actúa el elemento central, nos ayudará
a construir mucho mejor la molécula.

Esta disposición se pueden
generalizar a todos los oxoácidos de nomenclatura Stock tetraoxo.....(VI)
de hidrógeno y fórmula empírica HnXO4. ( H3PO4,
HClO4 etc.), siempre que el elemento se pueda rodear de doce electrones,
para lo cual es necesario que disponga de orbitales d próximos vacíos.
EJEMPLO 2:
FÓRMULA ESTRUCTURAL DEL ÁCIDO SULFUROSO
Repitiendo los pasos anteriores y partiendo de la denominación de TRIOXOSULFATO(IV)DE HIDRÓGENO, tendremos :
PASO 1: Al disponer el S, rodeado de 3 O, la disposición
en la que pueden estar más separados es la plana, de forma que cada O, se
sitúe en los vértices de un triángulo equilátero con centro en el S, sin embargo
al existir un par solitario, que también debe alojarse, la disposición espacial
será tetraédrica, con un lugar ocupado por dicho par. De esta forma la estructura
será de pirámide trigonal y el ángulo O-S-O, será de 109º grados.
PASO 2 y 3: Al repartir las 4 valencias del S entre 3 O,
surgirá un enlace S=O, quedando los otros dos O, también unidos a los H.
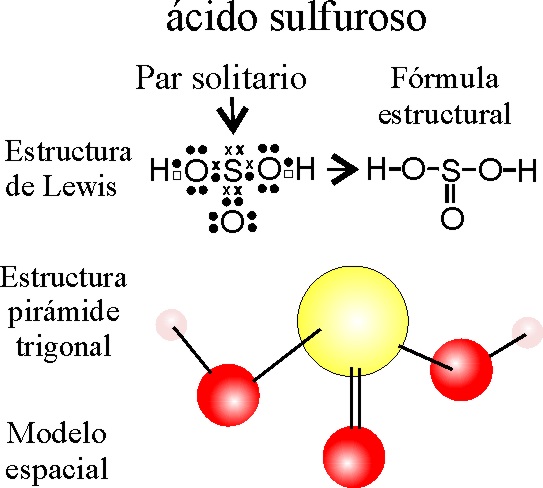
EJEMPLO 3: TRIOXOCLORATO(V)
DE HIDRÓGENO o ácido CLÓRICO (nomenclatura
tradicional)
1. Al igual que en el caso anterior, la disposición
de los 3 oxígenos, será tetraédrica y no triangular, al tener que considera
un par no compartido del elemento central, aunque en el encerado y por lo
tanto de forma plana, aparezca así.
2. Por lo general los H, positivos siempre
se unen al oxígeno, mientras que éste, negativo, lo hace al elemento central,
positivo en los oxoácidos. Sin embargo existen algunas excepciones.
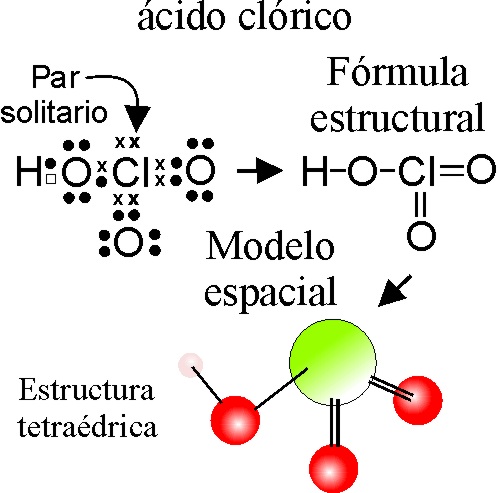
Esta estructura se puede
aplicar a ácidos del tipo
Ácidos
HXO3 o TRIOXO....(V) DE
HIDRÓGENO, como metafosfórico etc. con excepciones como en el
caso del ácido nítrico
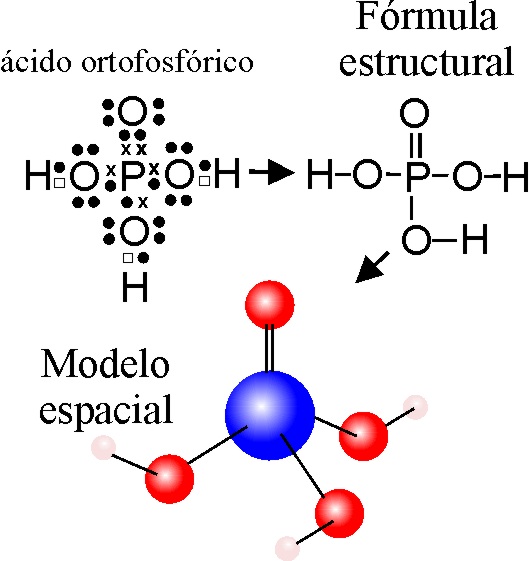
EJEMPLO
4:
Ácidos
H3XO4 o TETRAOXO... (V) DE HIDRÓGENO, como
el ortofosfórico etc.
La estructura es tetraédrica
o tetraédrica distorsionada, con un doble enlace X=O, mientras que los otros
3 O, se unen a los H.
OBSERVACIONES:
Muchas fórmulas estructurales
que en el encerado aparecen planas o incluso lineales, en la práctica no lo
son, puesto que puede ocurrir que el elemento central disponga de pares electrónicos
sin compartir. Estos pares no ligantes o solitarios distorsionan con su carga
eléctrica el espacio molecular ocupando un sitio, de tal forma que el elemento
central a la hora de rodearse de O, debe tener en cuenta cada par electrónico
no compartido como si fuera un elemento más que incluso deformará los ángulos
de enlace con repulsiones sobre los oxígenos y otros átomos ligados.
EJEMPLO 5:
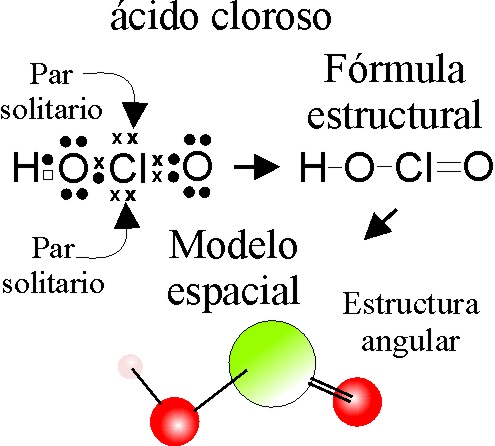
DIOXOCLORATO(III) DE HIDRÓGENO o ácido CLOROSO
(nomenclatura tradicional)
Este ácido surgiría en
el encerado con una disposición lineal, H-O-Cl=O y sin embargo el Cl tiene dos pares de electrones
que no entran en el juego del enlace (no ligantes o solitarios), lo cual hace
que deba disponer de 4 espacios a su alrededor: 2 para los pares lo más separados
posible, otro para la unión =O, y el cuarto para el O-H. Esto hace que la
molécula sea tetraédrica y no lineal, estando en vértices opuestos los grupos
=O y O-H y ocupando el Cl, el centro
del tetraedro. La estructura de la molécula será por lo tanto angular.
EXCEPCIONES:
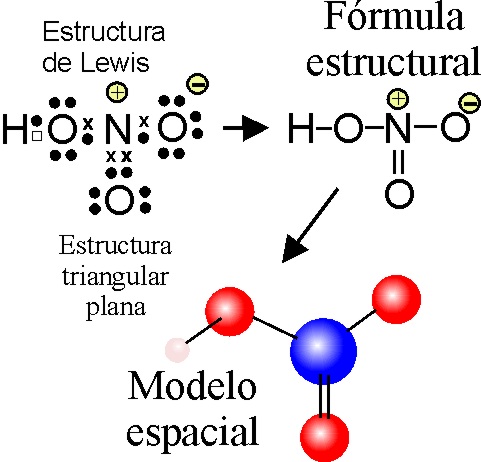
EJEMPLO 6
En el caso del HNO3,
se debe tener en cuenta que la estructura es plana triangular con ángulos
de aproximadamente 120 grados, repartiéndose aparentemente las 5 valencias entre 3 oxígenos, con lo que
se producirán dos enlaces X=O. El H se unirá al O al que le queda una valencia
sin saturar. Sin embargo esta estructura de Lewis, aparentemente lógica es
inviable dada la incapacidad del N para rodearse de un deceto de electrones,
al no existir un orbital 2d, teniendo que explicarse a través de estructuras resonantes, con un solo doble enlace N=O, que puede establecerse
ya con uno o con otro O, tal como se adjunta, con carga formal +1 sobre el
N, y -1 sobre un O (en amarillo), sin que se modifique la disposición espacial.
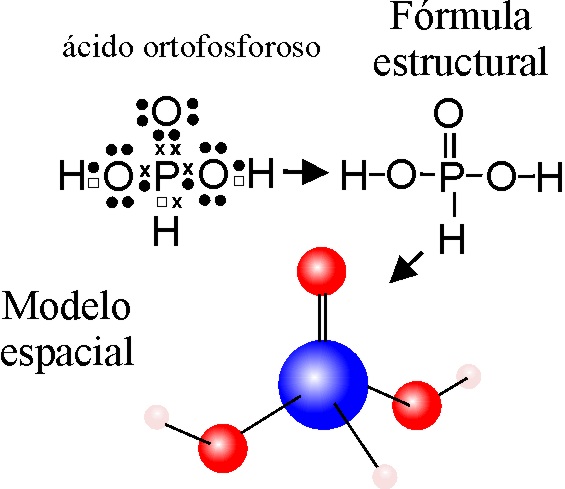
EJEMPLO 7: TRIOXOFOSFATO(III) DE HIDRÓGENO o ácido ortofosforoso (nomenclatura tradicional)
Este compuesto debería
tener una estructura plana triangular, al rodearse el P de 3 grupos O-H, sin
embargo este compuesto dispone de un H no disociable, y por lo tanto no unido
al O, pues no existen ortofosfitos sin hidrógeno [el anión ortofosfito es
(HPO3)2-]
El hecho se justifica por
la tendencia el P, mucho más voluminoso que el N, a tetracoordinarse, tomando
una dispo-sición tetraédrica, con un enlace anormal P-H. Por este motivo se
recomienda que no se denomine ortofosforoso, sino FOSFÓNICO.
2.2. OXOÁCIDOS
CON 2 O MAS NÚCLEOS CENTRALES
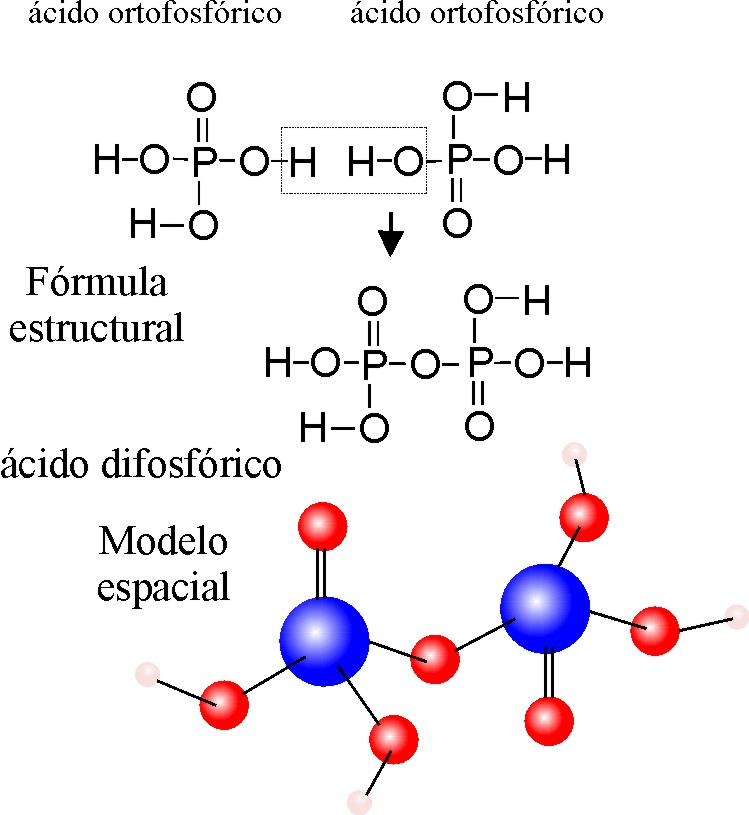
La formación
de este diácido como la de todos, implica una condensación a partir de 2 moléculas
del ortoácido (o del ácido más normal, en otros casos) con eliminación de
una molécula de agua.
PASO
1: Se escriben estructuralmente 2 moléculas de ácido ortofosfórico, tal como
se explica en el ejemplo 4.A partir de ellas por ruptura de un enlace P-O,
y otro H-O, se forma una molécula de agua
PASO 2: Se
une el O con su valencia libre, con el P, produciéndose así un puente de oxígeno
entre los dos núcleos de fósforo; P-O-P.
PASO 3:La
molécula giraría de forma que los grupos O= , estén lo más alejados posible
para evitar repul-siones.
OBSERVACIÓN: el puente de oxígeno X-O-X, es característico
de todos los diácidos, y en moléculas tetraédricas implicaría que dicho oxígeno
uniría por sus vértices a dos tetraedros
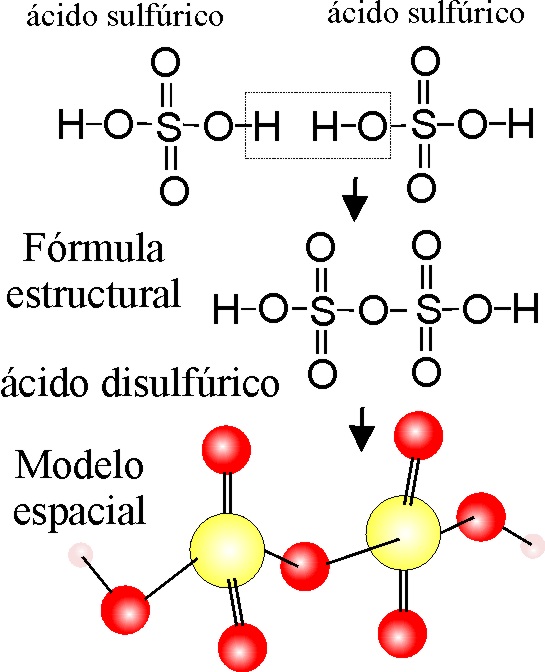
EJEMPLO 9: HEPTAOXODISULFATO(VI) DE HIDRÓGENO o
ácido DISULFÚRICO.
PASO 1: Se
escriben estructuralmente 2 moléculas de ácido sulfúrico, como en el ejemplo
1, eliminándose entre las 2 una molécula de agua H-OH, a partir del H de una
y de un OH de la otra.
PASO 2: Se
unen los elementos con valencias libres S y O, de las dos moléculas, formándose
el puente S-O-S, característico.
PASO 3: Se
ordena la molécula en el plano o espacio de forma que la repulsión de los
grupos oxo sea mínima.
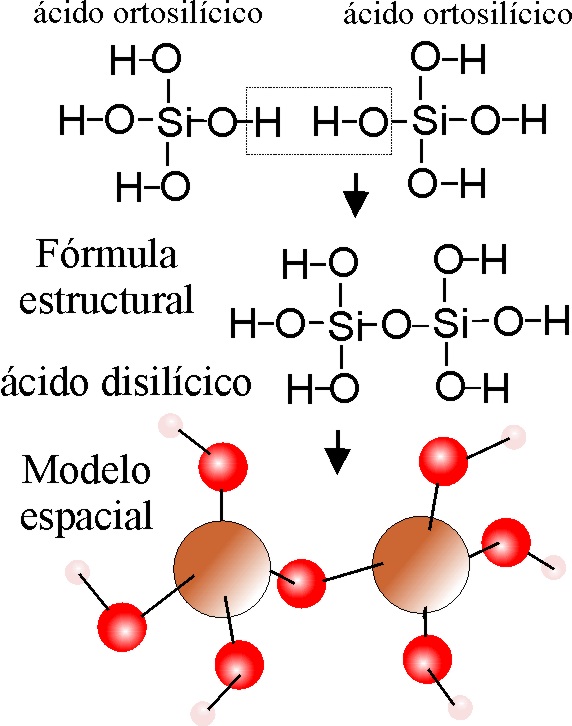
EJEMPLO 10:
ÁCIDOS DISILÍCICO Y TRISILÍCICO
En el primer
caso tomaríamos 2 moléculas de ortosilícico u TETRAOXOSILICATO(IV) DE HIDRÓGENO,
eliminado una molécula de agua, tal como hicimos anteriormente, mientras que
en el segundo, repetiríamos el proceso, pero con 3 moléculas de ácido, eliminando
2 moléculas de agua; una entre cada 2 de ácido, produciéndose por lo tanto
2 puentes de oxígeno:
Si-O-Si-O-Si.
3. FORMULACIÓN ESTRUCTURAL
DE TIOÁCIDOS.
Dado que los
tioácidos se forman por sustitución de uno o mas grupos oxo -O- o =O
de los oxoácidos (según indique el nombre),por
el grupo o grupos tio -S- o
S=, de igual capacidad combinativa, sólo tendremos que realizar dicha
operación una vez puesta la fórmula estructural del oxoácido "progenitor"
EJEMPLO 11:
TRIOXOTIOSULFATO(VI) DE
HIDRÓGENO o ácido TIOSULFÚRICO.
PASO 1: Se escribe la fórmula estructural del ácido progenitor o ácido sulfúrico en este caso, tal como en el ejemplo 1
PASO 2: Se sustituye un
grupo -O- por otro -S-
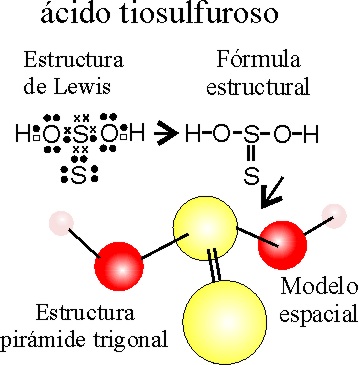
EJEMPLO 12:
DIOOXOTIOSULFATO(IV) DE
HIDRÓGENO o ácido TIOSULFUROSO.
PASO 1: Se
escribe la fórmula del ácido sulfuroso tal como en el ejemplo 2.
PASO 2: Se sustituye el grupo -O- por el -S-
OBSERVACIÓN
: A través de la fórmula estructural podremos comprender mejor los motivos
por los cuales no se puede simplificar la fórmula empírica del ácido tiosulfuroso
H2S2O2, dado que los dos S son diferentes
como se puede apreciar en la estructura: el S(2-) tiene mucho más volumen
que el S(4+).
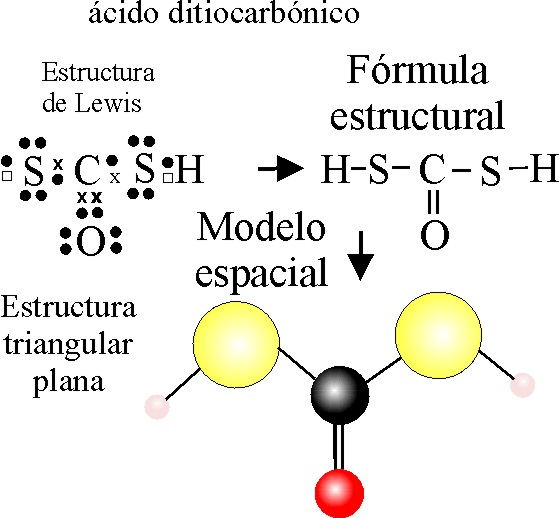
EJEMPLO 13:
OXODITIOCARBONATO(IV) DE HIDRÓGENO o ácido DITIOCARBÓNICO
PASO 1: Se escribe la fórmula del ácido carbónico, como en el ejemplo 2.
PASO 2:
Se sustituyen dos -O- por dos -S-.
OBSERVACIÓN:
La disposición geométrica de los tioácidos es semejante a la de los ácidos
progenitores, pues aun cuando el tio tiene más volumen que el oxo, su densidad
de carga eléctrica es menor, perturbando menos el espacio que lo rodea.

4. FORMULACIÓN
ESTRUCTURAL DE PEROXOÁCIDOS.
La estructura de los peroxoácidos mal llamados a veces perácidos, implica la sustitución de un grupo oxo –O-, por un peroxo -O-O-, de forma semejante al caso de los tioácidos. Sin embargo el grupo peroxo, al estar constituido por 2 átomos, y tener una geometría muy definida, va a provocar que no se pueda reemplazar cualquier grupo oxo =O o -O-, del oxoácido, sino sólo aquél que de lugar a una mayor estabilidad molecular; mayor alejamiento de zonas más densas electrónicamente, o un superior distanciamiento de grupos voluminosos (efecto estérico).La mejor forma de escribir la fórmula estructural sería, desarrollar primero la del ácido progenitor.
EJEMPLO 14:
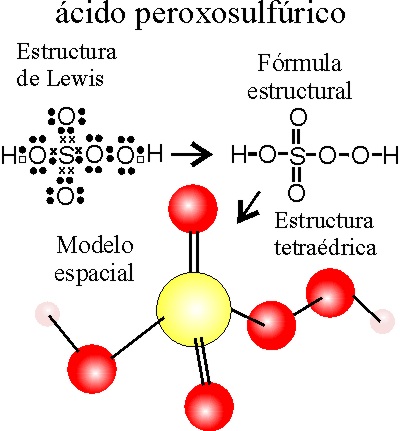
TRIOXOPEROXOSULFATO(VI) DE HIDRÓGENO o ácido PEROXOSULFÚRICO.
PASO 2:
Se sustituye un grupo-O- por un -O-O-
PASO 1:
Se escribe el ácido disulfúrico como en el ejemplo 9.
PASO 2:
Se sustituye el grupo -O- que actúa como puente, por un grupo -O-O-,con lo cual se produce un alejamiento
de los dos núcleos.
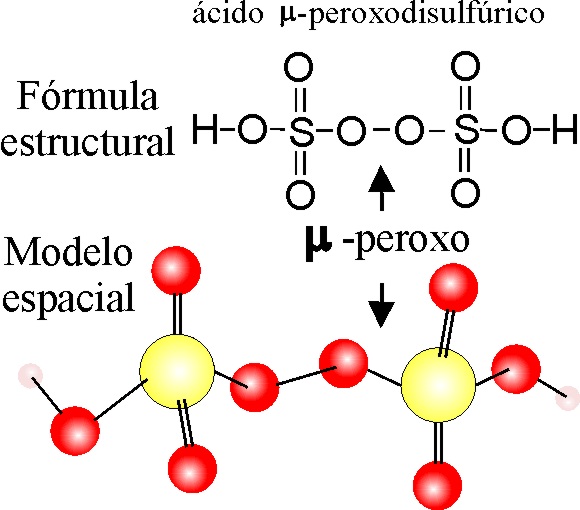
OBSERVACIÓN:
Estos peroxo diácidos, se deberían llamar empleando la nomenclatura sistemática,
teniendo en cuenta la repetición de los dos núcleos sobre el peroxo puente,
y dado que éste por esas características se nombra como
:-peroxo (mu
peroxo): ÁCIDO :-PEROXO-BIS[HIDROXODIOXOSULFÚRICO(VI)].
La designación de un grupo : (mu), se aplica sólo a aquellos que actúen como
puentes.
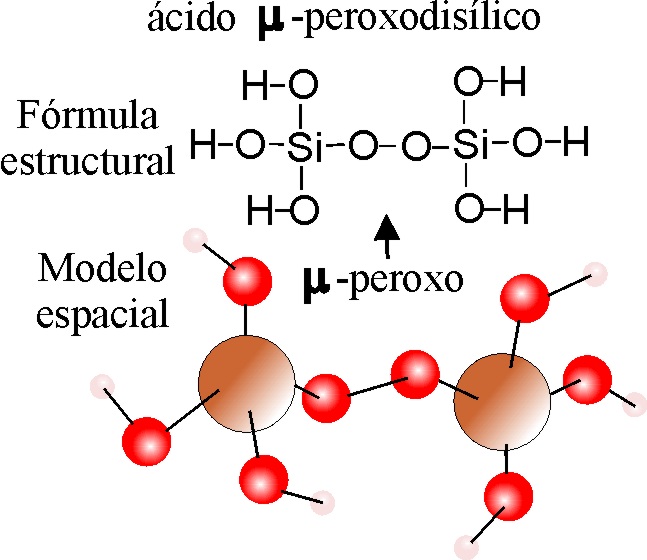
PEROXOHEXAOXODISILICATO(IV) DE HIDRÓGENO o ÁCIDO :-PEROXO-BIS[TRIHIDROXO SILICICO(IV)] o ácido PEROXODISILÍCICO.
PASO 1: Se escribe el ácido disilícico como en el ejemplo 10.
PASO 2:
Se sustituye el grupo oxo puente-O-, por un peroxo -O-O-
OBSERVACIÓN:
A través de la fórmula estructural se puede justificar el por qué no se puede
simplificar la fórmula del peroxodisilicato aunque empíricamente surja como
H6 Si2 O8 , dado que romperíamos la molécula
por el grupo peroxo, hecho que aparecería en todos los peroxoácidos con estas
características.
5. OXOÁCIDOS CON
FUNCIONES COMBINADAS.
Se sustituyen
los grupos oxo, de los oxoácidos, tantas veces como lo indique el nombre del
compuesto o el número de ligandos a formar.
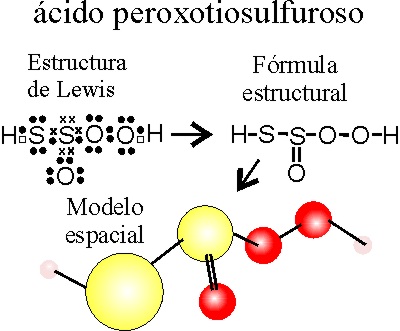
ÁCIDO OXOPEROXOTIOSULFÚRICO(IV) o OXOPEROXO-TIOSULFATO(IV) DE HIDRÓGENO o ácido PEROXOTIO SULFUROSO
PASO 1: Se escribe el ácido sulfuroso como progenitor (ejemplo 2)
PASO 2: Se sustituye un grupo oxo, -O- por un peroxo,-O-O-
PASO 3:
Se sustituye un grupo oxo,-O- por un tio, -S-
OBSERVACIÓN:
Cuando existen varios grupos ligandos o sustituyentes sobre en elemento central,
se nombran alfabéticamente, sin tener en cuenta el prefijo numérico.
EJEMPLO 18:
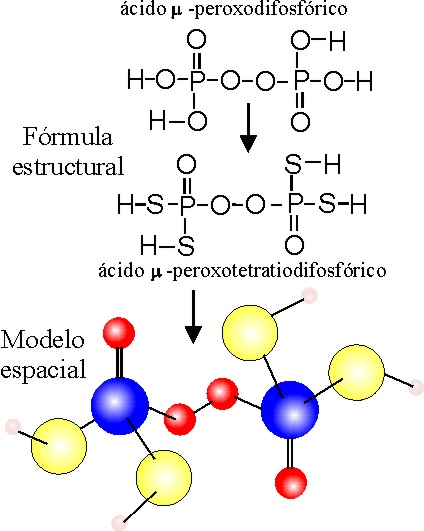
:-PEROXODIOXOTETRATIODIFOSFATO(V)
DE HIDRÓGENO o ácido :-peroxotetratiodifosfórico.
PASO 2: Se sustituye el grupo oxo -O- puente, por un peroxo -O-O-
PASO 3:
Se reemplazan lo más simétricamente posible cuatro oxos , por 4 tios
-S- [ 2 por cada núcleo de fósforo (V)]
EJEMPLO 19
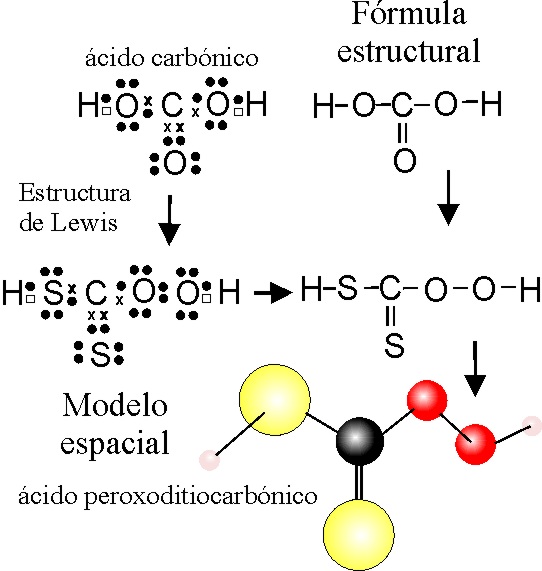
ÁCIDO PEROXODITIOCARBÓNICO
o peroxo-ditiocarbonato(IV) de hidrógeno
PASO 2: Se sustituye un grupo oxo, -O- por un peroxo, -O-O-
PASO 3: Se sustituye dos
grupos oxo, -O- y =O, por dos tios, -S- o =S
[1]
La teoría VSEPR, que se inició
en el trabajo de estereoquímica inorgánica, publicado en el Quarterly
Review, la única revista en tamaño de cuartilla, de la sociedad química
británica, se desarrollará en 1963, cuando se publica en el Journal of
Chemical Education
[2]
La teoría “Ligand Close-Packing” (LCP), aunque se
desarrolla a partir de 1997 y 98, realmente parte del modelo close-packing,
establecido por Bartell, ya en 1960, en algunos compuestos orgánicos