ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Nomenclatura y simbología orgánica V (continuación)
Reglas de la IUPAC(continuación)
Reglas de la sección C
En los compuestos orgánicos
conteniendo carbono, hidrógeno , oxígeno, nitrógeno,
halógenos, azufre, selenio y teluro, varía la filosofía de la nomenclatura,
respecto a la que regía en secciones anteriores. Debido a la posible complejidad
de algunos nombres, se permite el uso de varios tipos de nomenclaturas, y
no solamente la sustitutiva que había surgido en la conferencia de Ginebra,
y posteriores, y que había sido refrendada en la sección A de las normas IUPAC
1979.
Por eso la sección C introductoria,
se dedica a repasar los posibles sistemas de nomenclaturas empleados, que
se irán explicando con ejemplos. La idea es emplear siempre el sistema mas
sencillo que no dé lugar a equívocos. Se puede usar el sistema sustitutivo
( ya desarrollado en la sección A), el radicofuncional,
el aditivo, conjuntivo o de reemplazamiento, y en algunos casos el sustractivo,
empleando prefijos específicos. En todo caso, los principios generales expuestos
en la regla C-0.0 son:
a)
Determinación de las características del grupo empleado
como principal
b)
Determinación de la cadena principal
c)
Nombrar la estructura del grupo principal
d)
Determinar y nombrar
los sufijos y prefijos
e)
Numerar la cadena
f)
Reunir los nombres
parciales al nombre completo, usando los prefijos y el orden alfabético
El último punto hace referencia
a las características de las diferentes nomenclaturas empleadas.
Las reglas C-1 a C-10,
hacen referencia a los diferentes grupos que entran en la sección y estudian
sus constituyentes
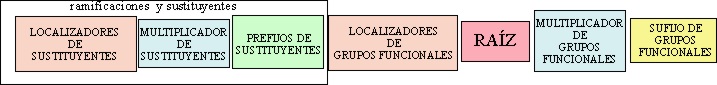
La estructura de un nombre
orgánico según la nomenclatura sustitutiva sigue el siguiente esquema:

Alcoholes
Las reglas C-2 comienzan
con el estudio de alcoholes y derivados.
Los alcoholes alifáticos,
se pueden nombrar por nomenclatura sustitutiva, tal como en Ginebra, con el
sufijo ol (Ejemplo:propanol) o por nomenclatura radicofuncional (alcohol propílico). Se prefiere
la primera.
Si el grupo OH, no está
en la cadena principal , entonces se prefiere nombrar
como radical hidroxi, como también ocurriría si hubiera otros
grupos que le precedieran en la tabla de ordenamiento de funciones
Así el ejemplo 28
Forma de nombrarlo
Se tienen 3 funciones alcohol, de forma
que la cadena principal deberá contener el mayor número de funciones alcohol.
Se eligirá la sucesión de carbonos mas larga que contenga el mayor número
de funciones alcohol. En este caso será 7 carbonos, con dos funciones OH:
heptanodiol. Se deberá de numerarar la cadena de acuerdo con las reglas A-2.3,
por lo tanto habrá que determinar las ramificaciones, según su alfabetización.
Se tiene un hidroximetil, y un metil (marcadas con círculo). Dado que la h
está delante que la m, se comenzará a numerar de forma que al hidroximetil
le corresponda el número inferior, con lo cual se tendrá un hidroximetil en
la posición 3, un metil en la 5, y dos grupos alcohol en la cadena principal
en las posiciones 2 y 6, por lo que su nombre será:
3-hidroximetil-5-metil-2,6-heptanodiol
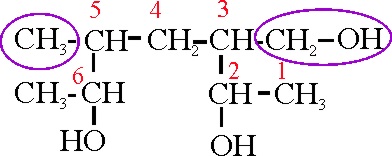
Ejemplo 28
También los alcoholes cuando
conviven con estructuras cíclicas, pueden nombrarse a través de la nomenclatura
conjuntiva.O sea reuniendo dos estructuras que configuren la fórmula, como
si se tratase de dos compuestos unidos que conservasen sus nombres, y se juntasen.
Vemos el ejemplo 29.
El compuesto dado está formado por dos núcleos,
un ciclohexano, y un etanol. Si se aplica la regla de prioridades, el etanol
la tiene, y el ciclohexano sería un sustituyente del H, así según una nomenclatura
sustitututiva se nombraría: 2-ciclohexil-1-etanol
Sin embargo, aunque
la anterior nomenclatura es preferente, también la IUPAC autoriza que se pueda
usa la nomenclatura conjuntiva, y es este caso el nombra se formaría por conjunción
del etanol y del ciclohexano:
Estaría explicitado en
la regla C-51 ( sólo se puede aplicar a estructuras
cíclicas)
Si el grupo OH está sobre
el ciclo, sin embargo no se puede aplicar
Vemos el ejemplo 30
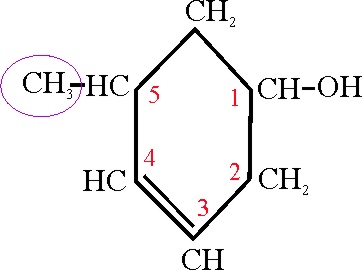
Ejemplo 30
El OH está sobre un ciclo de 6C con una
insaturación, por lo tanto su nombre fundamental será un ciclohexenol, que
se numerará partiendo de la posición del grupo OH, (C1) correspondiendo la
segunda preferencia al doble enlace (C3), por lo que el radical metilo estará
en la posición 5. Su nombre será:
5-metil-3-ciclohexen-1-ol
Éteres
Los éteres, isómeros de los alcoholes, pueden expresarse en tres tipos de nomenclaturas. Véase los ejemplos 31, 32 y 33.
En el ejemplo 31, tenemos una función éter,
unida a un grupo bencénico(fenilo), y un metilo.
Si se elige la nomenclatura sustitutiva (siempre preferente), la función éter
será un radical soportada por la forma hidrocarbonada con menor número de
carbonos, y por lo tanto se denominará metoxi, que sustituirá a un hidrógeno
del núcleo bencénico, tomada como cadena principal, denominándose : metoxibenceno.
Si se emplea la nomenclatura radicofuncional,
el nombra en español diferiría por su ordenamiento, del inglés. Así en español
empleando su alfabetización, sería :
Mientras que en inglés sería methyl phenyl ether
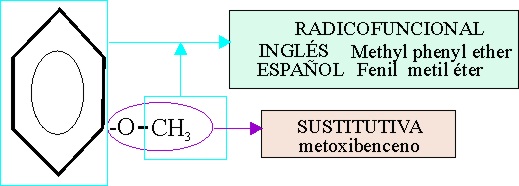
Ejemplo 31
También se puede emplear la nomenclatura
por remplazamiento, esto es considerando la cadena
principal como un todo hidrocarbonado, y sustituyendo o reemplazando en CH2,
por un –O-. En este caso el éter se caracteriza por el término oxa.
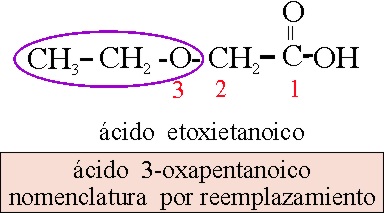
Ácido etoxietanoico,
o etoxiacético, empleando la nomenclatura sustitutiva. Sin embargo si se utiliza
la de reemplazamiento, se tiene que considerar una sucesión de 5 carbonos
con el grupo ácido: ácido pentanoico o valeriánico, y la sustitución
del carbono 3, por el éter (oxa).
Este tipo de nomenclatura de los éteres,
sólo se puede emplear cuando es grupo está en la cadena principal y existen
funciones dominantes.
Vemos el ejemplo 33. Si no existiera el
grupo éter, la sucesión de carbonos en la cadena principal sería 7 C, con
dos grupos aldehido (al), y un triple enlace, (ino).
El éter aparecería por sustitución de un
CH2, en la posición 5 por un O(oxa). Por
lo tanto aplicando las reglas ya estudiadas, su nombre sería: 5-oxa-2-heptinodial
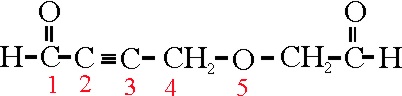
Ejemplo 33
Ejemplo 32
La denominación oxa, para los éteres como grupo sustituyente
en la cadena principal, no deberá confundirse con el oxo de aldehidos y cetonas, en la misma
circunstancia.
Cuando existen varias funciones éter, de forma sucesiva, siendo la función principal, se emplea siempre la nomenclatura de reemplazamiento, o sea como si fuera un hidrocarburo, contando el –O-, como si fuera –CH2-, pero indicándolo como en el ejemplo anterior (oxa), y numerándolo de forma que la suma de indicadores sea la mas baja posible. Véase el ejemplo 34.
Si se cosideran los –O- como –CH2-,
el compuesto tendría 11C, sería un undecano, ahora se reemplazarán dichos
carbonos por los grupos oxa, numerando las posiciones como se ha mencionado,
por lo que el nombre de dicho compuesto será:

Ejemplo 34
Cuando el grupo eter como
función secundaria, se junta en la cadena principal a grupos prioritarios
idénticos, la regla C-212, nos indica que la denominación no es oxa sino oxi, se toma como núcleo y se emplea una
nomenclatura por asamblea de unidades (variedad de la conjuntiva), como vemos
en el ejemplo 35
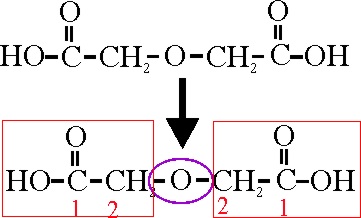
Los dos grupos iguales corresponden al ácido acético
o etanoico, unidos por un grupo éter (oxi). Como son iguales las uniones del
éter corresponden a las posiciones 2 y 2’, por lo que su nombre será:
Ácido 2,2’-oxidiacético o 2,2’-oxidietanoico
Ejemplo 35
Aldehidos
También en el grupo de
las reglas C-3, tenemos las aplicadas a aldehidos y cetonas.
Los aldehidos se caracterizan
por los sufijos "al", “aldehido” o ”carbaldehido”, o con
el prefijo “formil” cuando se presenta como grupo terminal,
o con el prefijo “oxo”, especialmente cuando se emplean nombres triviales
de compuestos con funciones prioritarias.
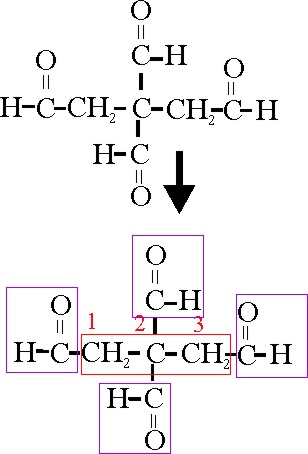
Cuado aparecen 3 funciones aldehido, conviene emplear un tipo de nomenclatura conjuntiva, como en el ejemplo 36
Aparece una estructura orgánica con 4 grupos
aldehido, por lo tanto hay dos soluciones:
O emplear la nomenclatura conjuntiva, situando
sobre un propano, cuatro aldehidos o
carbaldehidos, o emplear la nomenclatura susti-tutiva, considerando la cadena
principal un pentanodial, y agregándole dos radicales formil. –CHO.
Según eso el nombre del compuesto será:
1,2,2,3-Propanotetracarbaldehido o
Hay dos grupos aldehido sobre el núcleo bencénico. No se
debe formular metaformilbenzaldehido (nomenclatura sustitutiva), sino: 1,3-bencenodicar--baldehido ( nomenclatura conjuntiva)
También podría denominarse según su nombre trivial, derivado del dialdehido en posición orto ( aldehido ftálico), derivado del ácido del mismo nombre. En este caso la posición 1,3 sería: aldehido isoftálico. En el caso de una posición 1,4 sería aldehido terftálico.
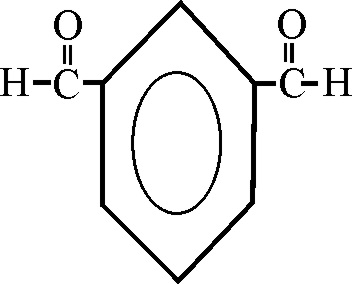
Ejemplo 37
Hay 3 etanales, o
acetaldehido, en las posiciones 1,2,4. sobre un núcleo de ciclohexano
(se eligen los números más bajos). Por lo tanto la nomenclatura mas simple para este compuesto, es la conjuntiva, o sea considerando
la conjunción de los 3 aldehidos con el ciclo. Por eso su nombre será:
1,2,4-ciclohexanotriacetaldehido (nombre trivial)
o 1,2,4-ciclohexanotrietanal (nombre sistemático)
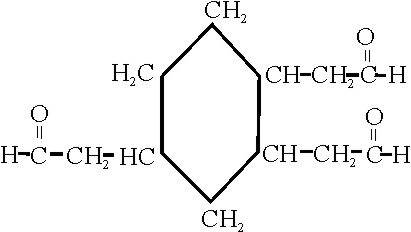
Ejemplo 38
Se dispone de un compuesto como el dado,
y en él se distinguen dos grupos aldehido, que no pueden considerarse en la
misma cadena principal. Se toma la mas larga, con
el mismo número de insaturaciones, como principal, como tiene 7C y un doble
enlace será un heptenal.
Se numera la cadena principal a partir del
la función principal, correspondiéndole al doble enlace la posición 5. Sobre
los carbonos 5 y 6, existen dos metilos como
ramificaciones, y sobre el 7, existe una ramificación cíclica, un ciclohexenil,
con doble enla-ce en la numeración del ciclo a partir de su inserción, de
forma que los localizadores correspondan a los números más bajos, en la posición
3, y un formil que sale de l carbono 4. Por lo tanto su nombre será:
7-(4-formil-3-ciclohexenil)-5,6-dimetil-5-heptenal
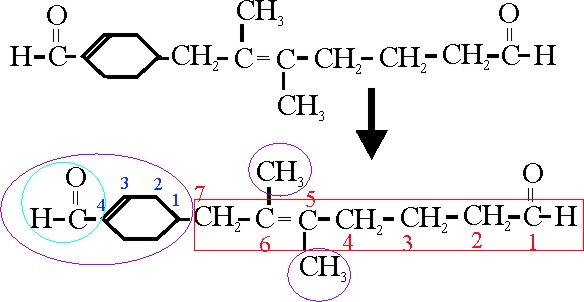
Ejemplo 39
Dicho compuesto puede llamarse:
ácido 4-formilbutírico o 5-oxovaleriánico
o 5-oxopentanoico
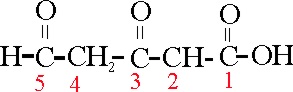
Ejemplo 40
Cetonas
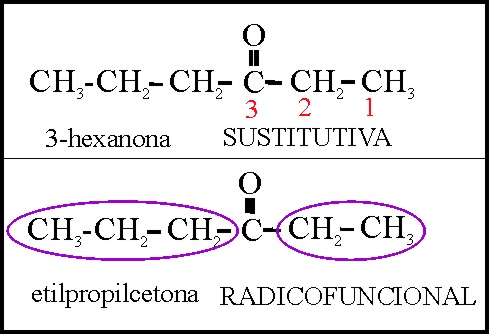
Las cetonas presentan algunas complicaciones. Deberán ser nombradas o mediante el sufijo ona (cuando es función dominante), o con el prefijo oxo (reglas C-311 y siguientes), en la nomenclatura sustitutiva, pero también pueden emplearse el sistema radicofuncional (menos recomendado), y en este caso los radicales se nombrarían alfabéticamente. Lo vemos en el ejemplo 41 y 42.
En el segundo, la nomenclatura es radicofuncional,
tomando como centro el grupo cetónico y considerando radicales el metilo y
el hidroximetilo, por lo que su nombre será ordenado alafabéticamente: 2-hidroxietil-metilcetona
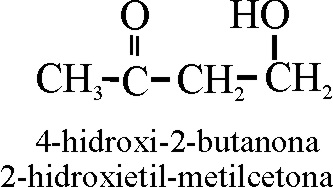
Ejemplo 42
Ejemplo 41
Ejemplo 43
Algunas cetonas tienen
nombres triviales como:
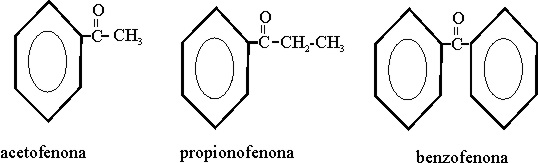
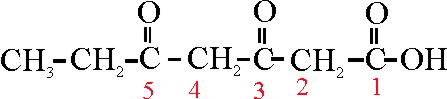
Ejemplo 44
Ejemplo 45
Las cetonas pueden no diferenciarse
de los aldehidos en su nomenclatura, y sólo hacerlo en función de su posición,
especialmente cuando actúan como sufijo, como se puede ver en el ejemplo 46.
Sobre una estructura de 6C, hay un grupo ácido(C1), 1 cetónico(C3) y otro aldehído (C6), por lo que su
nombre podría ser:
ácido 3,6-dioxohexanoico ( no se diferencia aldehido y cetona), o
ácido 5-formil-3-oxopentanoico (se diferencia el aldehido
de la cetona en la nomenclatura)
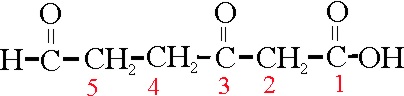
Ejemplo 46
Ácidos
Se encuentran especificados
en las reglas de la IUPAC, C-4 y C-400, y sus derivadas.
Los saturados se caracterizan
por el sufijo “anoico” y también carboxílico
(correspondiendo al grupo), mientras que como ramificación, se caracteriza
por el prefijo carboxi, o el radical carboxil.
En la nomenclatura sustitutiva
aparece con el sufijo anoico, correspondiendo (por lo general) al carbono
C1, como se ha visto en los ejemplos anteriores 45, 43 , 39 y 33.
Tal como cuando se trató de los aldehidos, se emplea
la nomenclatura conjuntiva, cuando existan mas de
dos funciones, o cuando se encuentran
sobre ciclos y anillos aromáticos, como vemos en los ejemplos 47, 48 y 49.
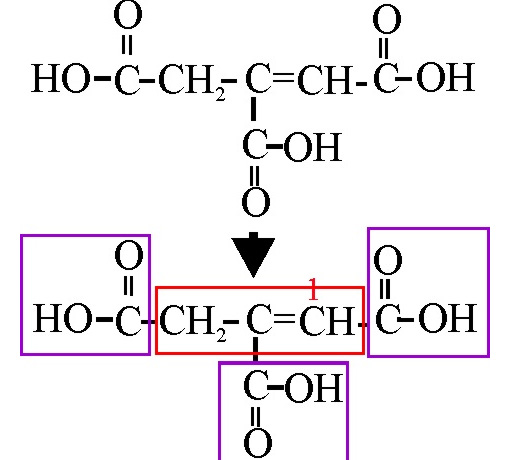
Ejemplo 47
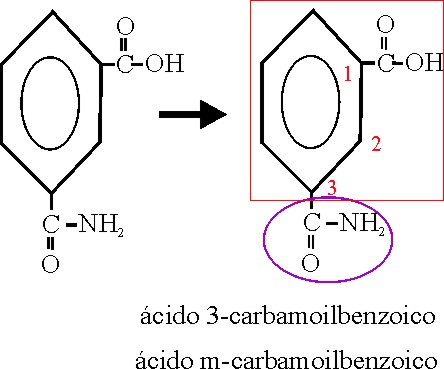
En el ejemplo 47, aparecen 3 funciones carboxilo,
sobre un propeno. Pues bien, aunque sea prioritario el grupo ácido, para facilitar
la nomenclatura, se toma como la conjunción de dichos 3 grupos con el propeno
que se numerará, de forma que al doble enlace le corresponda el número mas
bajo. Por eso el nombre será:
Ácido 1-propeno-1,2,3-tricarboxílico.
No se debe nombrar tomando como cadena principal la sucesión de carbonos con los dos grupos ácidos, como si fuera un ácido pentenodioico, con una ramificación carboxil.
En este ejemplo tenemos el grupo ácido, sustituyendo a un hidrógeno
de un ciclohexano, con un grupo carbonilo. Tomando las dos formas, la cíclica
y la ácida, y considerando el grupo cetónico como un oxo, por reemplazamiento del
CH2 por C=O, y previa numeración del anillo a partir de la inserción
del grupo ácido, la conjunción produciría
el siguiente nombre:
Ácido 3-oxociclohexanocarboxílico.
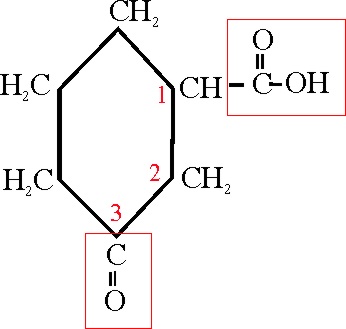
Ejemplo 48
Por la misma razón del ejemplo 47, se nombraría:
Ácido 1,2,4-ciclohexanotricarboxílico
(siempre la numeración del ciclo debe corresponder a los cardinales inferiores)
Sin embargo, si el grupo
carboxilo, está fuera de la cadena principal que contiene otros dos grupos
carboxilos, pero unido a otros carbonos, ya no se puede formular como en el
ejemplo 45.
La cadena principal, tiene 6 C, y dos grupos
ácidos, por lo tanto será un hexanodioico, y sobre el C3, existen
dos ramificaciones iguales, con un carbono (metil), y un grupo ácido (carboxil),
cada una. Por lo que su nombre será en nomenclatura sustitutiva:
Ácido 3,3–bis(carboximetil) hexano-dioico
Debe observarse que las ramificaciones complejas,
se nombran como los éteres, o sea desde fuera hacia la cadena principal donde
se inserta.
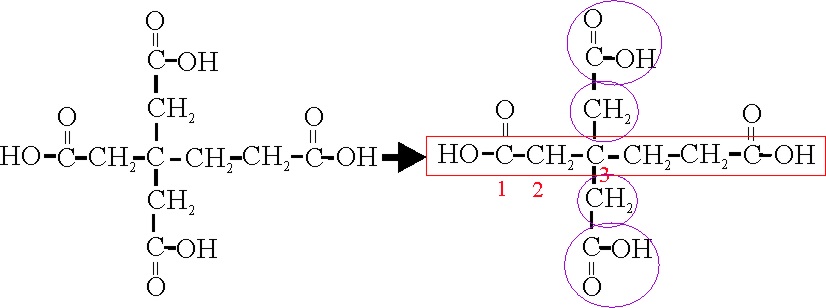
Ejemplo 50
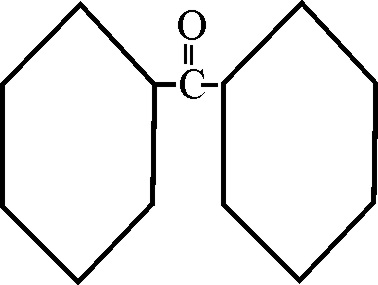
En dicho ejemplo, al emplear la nomenclatura
sustitutiva, se parte del ácido benzoico, como cadena principal, siendo la
función cetona una ramificación, que se deneminará a partir del radical butil
(4 carbonos), numerándolo a partir de la insercción en el núcleo bencénico,
con lo cual al grupo cetónico (oxo), le corresponde la posición 3. Por otra
parte esta ramificación está en posición para respecto a la función ácida
dominante ( entre sí 1,4), por lo que el nombre será:
Ácido p-(3-oxobutil) benzoico
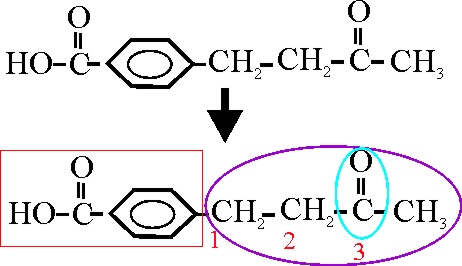
Ejemplo 51
Cuando junto a la función ácida existen otras de menor categoría como la aldehido, se puede emplear el sistema del ejemplo 46, o sea descontar un carbono al ácido, como cadena principal, y tratar el aldehido como formil.
Derivados
de ácidos
Sales
y ésteres
Están definidos por las
reglas C-461 y siguientes. y caracterizados por el
sufijo oato. Si
las sales son ácidas, deberán llevar el prefijo “hidrógeno”,
tal como en la formulación inorgánica.
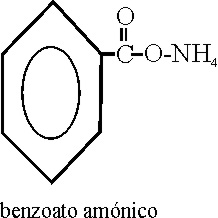
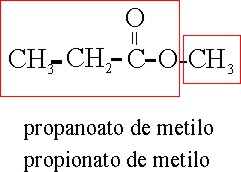
Ejemplo 52
Haluros
de ácidos (Regla C-481 y siguentes)
Como los aniones tienen
prioridad, la parte orgánica se nombrará como un radical, pudiéndose emplear
en ella, cualquier nomenclatura que facilite su nombramiento.En el ejemplo
53 que se da, se emplea una nomenclatura conjuntiva, uniendo los conjuntos
del ciclohexano con el grupo carbonilo. En este caso el grupo ácido al eliminarse
el OH, que es sustituido por el halógeno,deja de
ser carboxil, para surgir como carbonil.
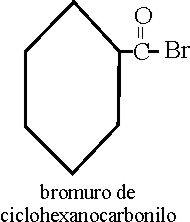
Ejemplo 53
Anhídridos
de ácido (C-491 y siguientes)
Como su nombre indica,
se obtienen de eliminar una molécula de agua, de 2 moléculas de ácido, o de
una molécula si se trata de un ácido dioico. Su nombre corresponde al del
ácido precedido por la palabra anhídrido, si el ácido fuera complejo podría
ir precedido del multiplicativo de grupo,
bis.
Véanse los ejemplos 54,
55 y 56.
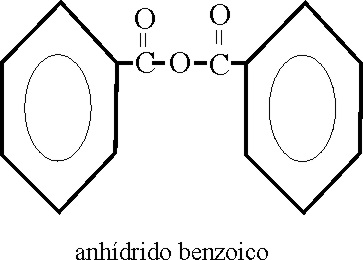
Ejemplo 54
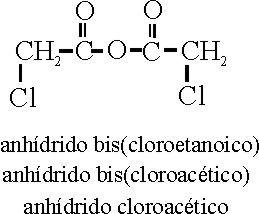
Ejemplo 55
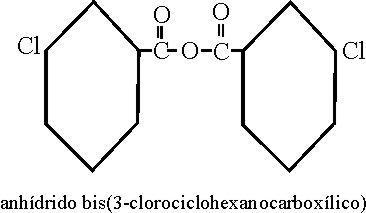
Ejemplo 56
Si el anhídrido procede
de dos ácidos monobásicos diferentes, se
nombrarán por orden alfabético
Compuestos
nitrogenados ( Reglas C-8 y sucesivas).
Derivados
del ácido: amidas y nitrilos.
Amidas
Los compuestos que contienen
1, 2 o 3 grupos acidos unidos al nitrógeno reciben el nombre genérico de amidas,
y según sea 1, 2 o 3, serán primarias, secundarias y terciarias. Su nomenclatura
se obtiene por sustitución del ácido -oico por “amida”, o del ácido carboxílico
por “carboxamida” (C-821 y C-822).
Si emplease el nombre trivial del ácido, se sustituiría el –ico, por amida. Si en las amidas
primarias, se sustituyese el H, del NH2, por un radical orgánico,
el nombre se daría alfabéticamente, precedido de la letra N mayúscula
separado por un guión. Si actúa como un sustituyente, el prefijo correspondiente
es “carbamoil”.Véanse los ejemplos
57 , 58, 59 y 60
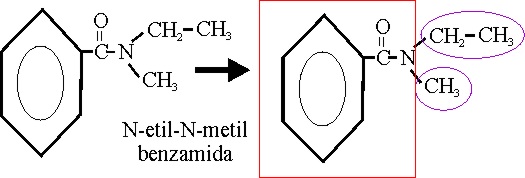
Ejemplo 57
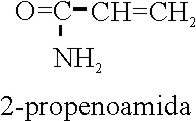
Ejemplo 58
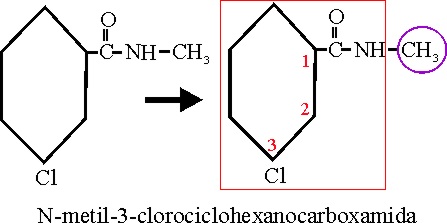
Ejemplo 59
Ejemplo 60
Nitrilos(
reglas C- 831 y sucesivas)
Los nitrilos deben contener
el grupo –CN (nomenclatura sustitutiva),
o ciano , u cianuro (nomenclatura radicofuncional).
Su nombre se obtiene a partir del del hidrocarburo, cuyo H sustituye, agregándole
un bono mas con el sufijo “nitrilo”, siendo este carbono el 1, al numerar la cadena.
Pero si se consideran derivados del ácido carboxílico correspondiente, su
nombre derivaría del de aquél, cambiando ácido carboxílico por “carbonitrilo”, grupo que contiene un carbono.
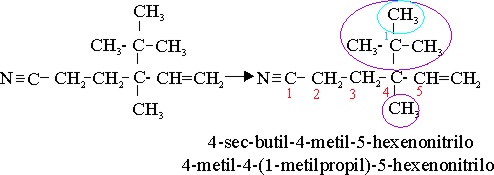
Ejemplo 61
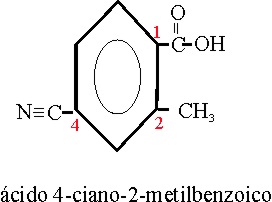
Ejemplo 62
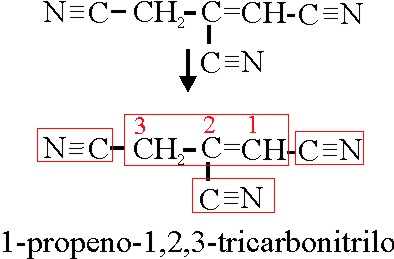
Ejemplo 63
Aminas (C-811 y
siguientes y C-11)
La nomenclatura de las
aminas, es similar a la de las amidas, sustituyendo el radical ácido por otro
hidrocarbonado. El sufijo es “amina”.
Cuando actúa como ramificación, se denomina “amino”.Puede emplearse la nomenclatura sustitutiva, y la radicofuncional.(Ej.
64-70)
Si existen varias como
función secundaria en la cadena principal, sustituyendo a un grupo CH2,
se empleará el término aza (Ej.71).
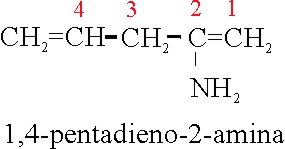
Ejemplo 64
Ejemplo 65
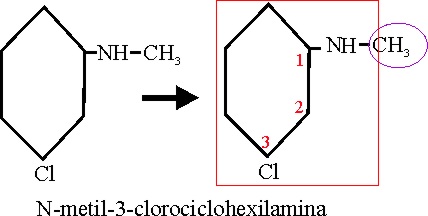
Ejemplo 68
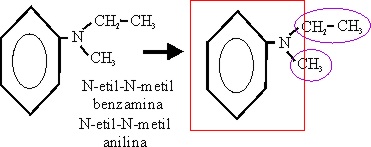
Ejemplo 66
Ejemplo 69
Ejemplo 70
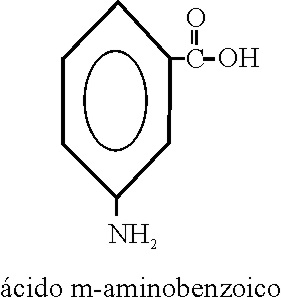
Ejemplo 67
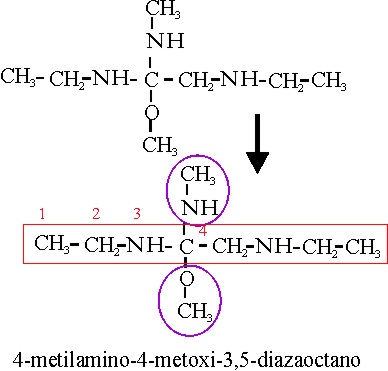
Ejemplo 71
El
centenario de Ginebra
Llega el 1992, y con él, el centenario de la Conferencia
de Ginebra. Se reune una nueva conferencia en Ginebra, y filosofía general
es la vuelta a un purismo clarificador. Se amplían las reglas del 79, y se
edita la guía de la nomenclatura, que complementa el libro azul. Los puntos
que se modifican son:
a) Los radicales hidrocarbonados,
deberán conservar la raíz del hidrocarburo del que derivan.Así del metano,
se producirá el metanil y del butano el butanil, tal como del buteno es el
butenil, no metil ni butil.
b) El localizador deberá
estar inmediatamente delante de lo que trate de localizar, sea un sufijo familiar,
sea una ramificación ; con esta nueva regla se simplificarán
las ramificaciones complejas.
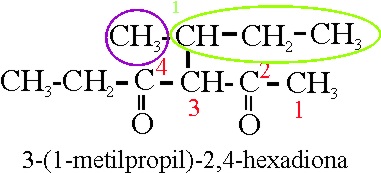
De esa forma, el ejemplo
43:
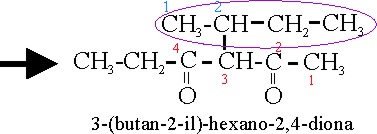
Vamos a analizar
el nuevo nombre:3-(butan-2-il) hexano-2,4-diona.
La ramificación que denominaríamos metilpropil,
sale de la cadena principal del carbono 3, numerándola de forma que a la función
principal le corresponda el número más bajo.Pero como son 4 carbonos, antes
se podía denominar también butil, y puesto que la inserción se hacía por un
carbono secundario sería sec-butil. El butil deriva del butano como radical,
o sea que deberá ser butanil, y la inserción en la cadena principal o formación
del radical, en él (sufijo il) se origina en su carbono 2 .Por eso sería 2-butanil
, pero como el localizador se ha de situar inmediatamente delante de lo que
localiza, dicha rama sería butan-2-il. La cadena principal no sufre modificaciones,
con las nuevas reglas, salvo en la disposición de los localizadores (
inmediatamente delante de lo que tratan de localizar)

c) Sólo una función orgánica, puede vincularse
a un sufijo.
La estructura de la nueva
nomenclatura será:
Tomemos otro compuesto muy simple el ácido 4-metilpentanoico o 4 metilvaleriánico
¿Cómo se lamaría según ña guía de nomenclatura, editada después del congreso
de Ginebra de 1992?. Pues sencillamente
: 4-metanilpentano-1-oico
Vamos a reorganizar los
nombres de los compuestos desarrollados como ejemplos, comparando su nomenclatura
del libro azul 1979, con la guía de nomenclatura 1993.
|
Ej |
Nombre según libro azul 1979 |
Nombre según la guía de nomenclatura 1993 |
| 28 |
3-hidroximetil-5-metil-2,6-heptanodiol |
3-hidroximetanil-5-metanilheptano-2,6-diol |
| 30 |
5-metil-3-ciclohexen-1-ol |
5-metanilciclohex-3-eno-1-ol |
| 32 |
Ácido 3-oxapentanoico |
Ácido 3-oxapentan-1-oico |
| 33 |
5-oxa-2-heptinodial |
5-oxahept-2-ino-1,7-dial |
| 36 |
1,2,2,4-propanotetracarbaldehido |
Propano-1,2,2,4-tetracarbaldehido |
| 38 |
1,2,4-ciclohexanotriacetaldehido |
Ciclohexano-1,2,4-triacetaldehido |
| 39 |
7-(4-formil-3-ciclolhexil)-5,6-dimetil-5-heptinal |
7-(4-formil-3-ciclohexanil)-5,6-dimetilhept-5-ino-1-al |
| 41 |
3-hexanona |
Hexan-3-ona |
| 42 |
4-hidroxi-2-butanona |
4-hidroxibutan-2-ona |
| 43 |
3-(1-metilpropil)-2,4-hexanodiona |
3-butan-2-ilhexano-2,4-diona |
| 47 |
Ácido 1-propeno-1,2,3-tricarboxílico |
Ácido prop-1-eno-1,2,3-tricarboxílico |
| 49 |
Ácido 1,2,4-ciclohexanotricarboxílico |
Ácido ciclohexano-1,2,4-tricarboxílico |
| 50 |
Ácido 3,3-bis(carboximetil)hexanodioico |
Ácido 3,3-bis(carboximetanil)hexano-1,6-dioico |
| 51 |
Ácido p-(3oxobutil)benzoico |
Ácido p-(3-oxobutanil)benzoico |
| 52 |
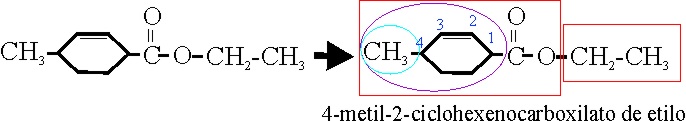
4-metil-2-ciclohexenocarboxilato
de etilo |
4-metanilciclohex-2-enocarboxilato
de etilo |
| 57 |
2-propenoamida |
Prop-2-eno-1-amida |
| 58 |
N-etil-N-metilbenzamida |
N-etanil-N-metanilbencenoamida |
| 61 |
4-sec-butil-4-metil-5-hexenonitrilo |
4-(butan-2-il)-4-metanilhex-2-eno-1-nitrilo |
| 62 |
4-ciano-2-metilbenzoico |
4-ciano-2-metanilbenzoico |
| 63 |
1-propeno-1,2,3-tricarbonitrilo |
Prop-1-eno-1,2,3-tricarbonitrilo |
| 65 |
1,4-pentadieno-2-amina |
Penta-1,4-dieno-2-amina |
| 66 |
N-etil-N-metilanilina |
N-etanil-N-metanianilina |
| 70 |
4-metilamino-4-metoxi-3,5-diazaoctano |
4-metanilamino-4-matanoxi-3,5-diazaoctano |
En
la práctica real, no se siguen las normas de la guía, y si el libro azul.
Todo lo mas, la disposición de los localizadores
inmediatamente delante de lo que trata de localizar.
¿Se pondrá de acuerdo toda
la sociedad química para adoptar las nuevas normas?.¿Cuánto
durarán éstas?.
El tiempo se encargará
de clarificar las respuestas.