Tabla 10
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Simbolismo y nomenclatura orgánica II
Aparición
de la valencia y su influencia en la simbología química.
En 1833, en los Anales
de química, aparece un trabajo de Gaudin, en el que define la atomicidad como
el número de átomos en una molécula. En 1840, se empleaba la equivalencia
para determinar las fórmulas de los compuestos. La equivalencia significaba
el valor reemplazable de un elemento o grupo con el hidrógeno. En 1852, Frankland
en un artículo escrito en el Philosophical Transactions incide que todos los
elementos al formar compuestos lo hacen con un número definido de otros elementos
y lo denomina poder combinativo
[45]
. A partir de 1860, comienza a usarse el término de atomicidad,
como sinónimo a poder combinativo
[46]
. En 1864, en Inglaterra, Odling
[47]
que había traducido al inglés los trabajos de Laurent, propone los términos de mónadas, díadas, tríadas,
tétradas etc, para aquellos elementos que se combinaban con uno, dos, tres
y cuatro. En los trabajos de Kekulé
[48]
,
[49]
, Couper y de Hofmann del 1865
[50]
, aparece el término de cuantivalencia, y por fin en 1868,
surge por primera vez por escrito, el término de valencia, en un trabajo de
Wichelhaus
[51]
, publicado en un suplemento de los Anales de Química de
ese año. Ese término compartiría uso con el de saturación y con el de atomicidad,
llegando con el tiempo a desplazarlos completamente.
Ampliación
de la teoría de los tipos
[52]
Posteriormente, en 1858,
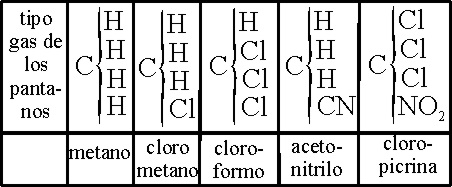
Kekulé agregó el tipo gas de los pantanos junto la asignación de 4 a las afinidades del carbono (tabla 10).
Sin embargo incurrió en
un gran error, pues utilizando los pesos atómicos de Gerhardt, que se basaba
en el C,12, empleó los carbonos partidos que indicaban
formulación de cuatro volúmenes, con lo cual contribuyó al caos formulatorio
general.
También introdujo los compuestos
de azufre en la teoría de los tipos, a partir del H2S (tabla 11).

Tabla 10
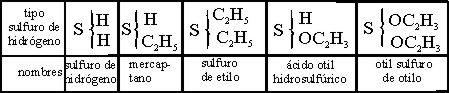
Tabla 11
En 1857, Odling
[53]
, generalizó la idea de los tipos múltiples, e introdujo
el empleo de comillas para indicar el valor sustituible o
sea el número de átomos de hidrógeno que el radical podía sustituir (tabla
12). Así se explicaron moléculas como los ácidos del fósforo con tipos dobles
y triples e incluso el alumbre en un tipo cuádruple (tabla 13).
Kekulé y Odling, también
introdujeron los tipos mixtos en moléculas como el hidróxido amónico (fig. 28) o el tiosulfato sódico
(fig.29).
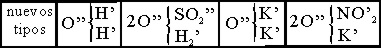 Tabla
12
Tabla
12
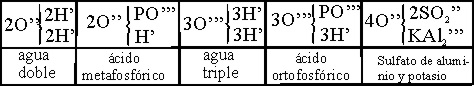
Tabla 13
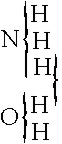
Fig.28
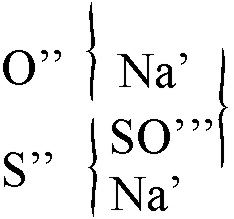
Fig.29
A partir de 1855, el alemán
Kolbe que no estaba de acuerdo con la teoría francesa de los tipos, creó unos
nuevos tipos; los tipos de Kolbe o “teoría de los tipos más nuevos”. Partía
de la idea que los ácidos orgánicos
son derivados del ácido carbónico, por sustitución. El problema era que empleaba
fórmulas de 4 volúmenes por eso las fórmulas de la tabla 14, nos parecen extrañas.
Dos años después, en un
trabajo publicado en los Anales de química farmacéutica, apoya la tetra atomicidad
del “carbonilo”, pero considerando el
átomo de carbono doble (C barrado). Sin embargo lo más importante fue que
al estipular como derivados del carbónico, a los ácidos orgánicos, sugiere
que todos llevan una agrupación atómica definida, que llamó grupo carboxilo,
introduciendo el significado de función orgánica en la formulación
[54]
.
Otro alemán, Wurtz, extiende
el tipo agua, a un sistema multiplicativo en el oxígeno, naturalmente, emplea
tanto el carbono doble como el oxígeno doble, en la notación alemana ( tabla
15).
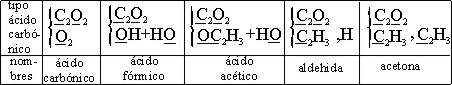
Tabla 14
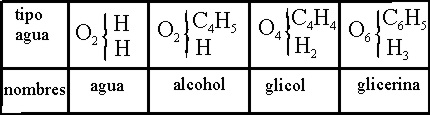
Tabla 15
Los
nuevos modelos de formulación
La aparición de
la raya de enlace.
El 14 de junio de 1858,
aparece una nota en la revista Comptes Rendus, debida a un químico escocés.
Archibald Scott Couper, que marcará un hito en la historia de la química.
La nota se titulaba: “Sur une nouvelle théorie chimique”. En ella aparecerá
por primera vez la raya entre los carbonos, en una fórmula química
[55]
, referida al ácido salicílico y al triclorofosfato de salicilo
(todavía no se conocía el anillo bencénico) (fig.30).
Naturalmente comenzó uniendo
con puntos (líneas de combinación) los átomos, dentro de la teoría de los
tipos, tal como se aprecia en la tabla. Después pasó a sustituir los puntos
por rayas, y de ahí surgirá la raya de enlace
[56]
, aunque dicho término aparecerá mas tarde. En las tablas
adjuntas 16 y 17 se aprecia la formulación que empleó Couper.
En el trabajo
“Sobre una nueva teoría química”, también aparece la referencia a los cuatro
grados de afinidad del carbono, y la
posibilidad de que éste se combinara consigo mismo formando cadenas
[57]
. Éste fue el paso fundamental que cambiaría formulación
de la química de los compuestos del carbono; Couper sólo tenía 27 años.
Un año después se retiró
de la investigación debido a una grave enfermedad nerviosa, muriendo a los
61 años. Su discípulo, el también escocés Alexander Crum Brown, seguiría sus
ideas y establecería los modelos de formulación estructural de los compuestos
de carbono.
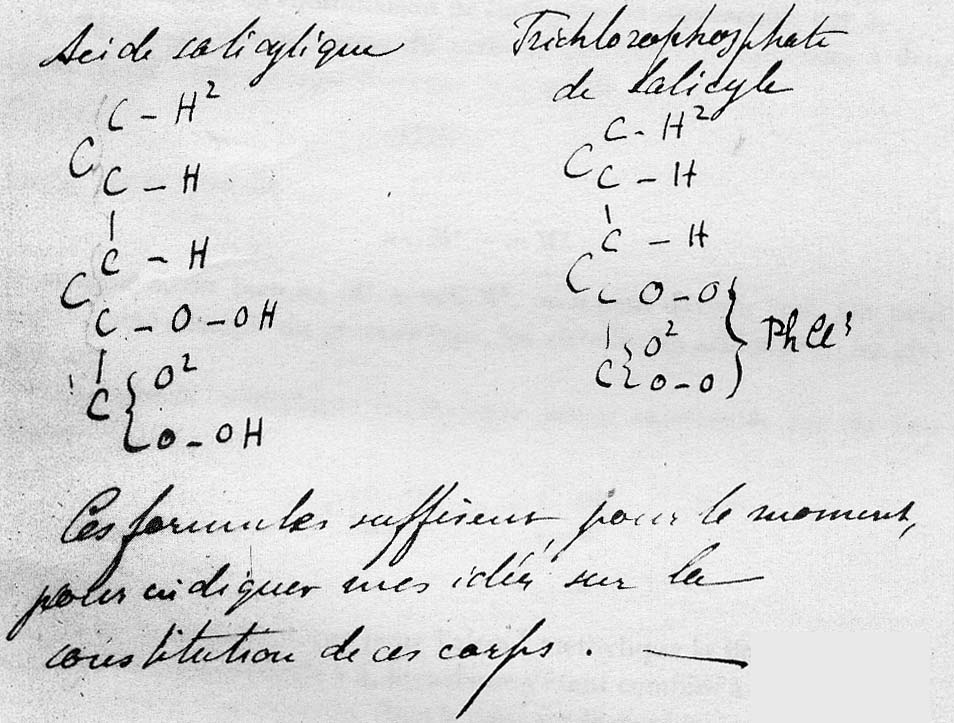
Fig.30
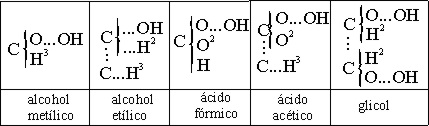
Tabla 16
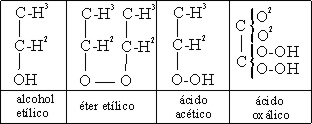
Tabla 17
Para aclarar los modelos
de formulación se creó el sistema de tipos, pero a su vez también fracasó,
ya que proliferaron tantos tipos diferentes, que un mismo compuesto podría
adscribirse a diferentes tipos, y por lo tanto aparecer con diferentes fórmulas,
como era el caso del ácido sulfúrico (fig.31), que podía escribirse del tipo
agua simple, agua doble o del tipo mixto.
Este era el
panorama en 1860, antes del congreso de Karlsruhe, que no consiguió aclarar
nada. El caos en la formulación orgánica era total, hasta tal punto que Kekulé
recopiló en 1868, nada menos que 19 fórmulas diferentes para el ácido acético,
y lo que era peor, todo químico orgánico debería tener sus propias fórmulas,
para sentirse importante.
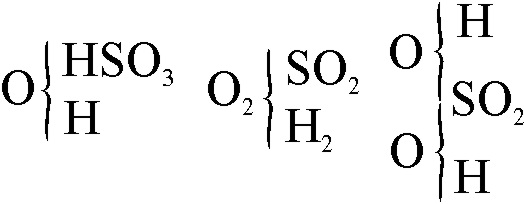
Fig.31
Kekulé que había ampliado la teoría de los tipos, en
1860, involucrándose junto con Odling
en los tipos mixtos para explicar fórmulas inorgánicas como la del hidróxido
amónico, retoma el simbolismo gráfico que habían iniciado Dalton y Gaudin,
con las fórmulas irónicamente llamadas “salchichas”
[58]
, por su estructura, y así formula el gas de los pantanos,
el amoniaco y otros muchos compuestos (fig.32) como la acetona
(fig.33) e incluso el mismo benceno (fig.34) en el año 1865
[59]
. En este modelo, se aprecia la consideración de los dobles
enlaces entre las “salchichas”, pero de una forma diferente a la empleada
por Crum Brown, como se verá después.

Fig.32
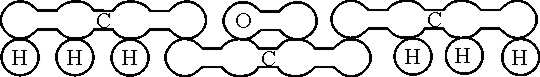
Fig.33

Fig.34
En 1866, Erlenmeyer
sugirió que el naftaleno que había sido descubierto 47 años antes en el alquitrán
de hulla, estaba formado por dos anillos bencénicos unidos (fig.37). Dos años
después Grabe y Lieberman, justifican el antraceno
[63]
, también descubierto mucho tiempo antes en la misma sustancia,
con una estructura de tres anillos bencénicos soldados (fig.38). Todavía no
se habían adaptado y generalizado las insaturaciones a los anillos.
Ya se había demostrado que no todos los hidrógenos
eran iguales, y que existían isómeros de posición, que Körner, otro discípulo
de Kekulé, había llamado orto, meta y para
[64]
.

Fig.35
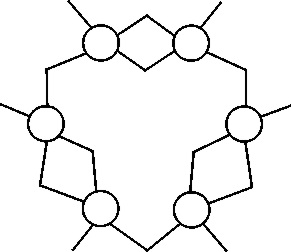
Fig.36
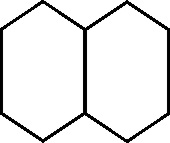
Fig.37
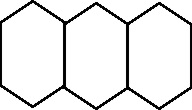
Fig.38
Las interpretaciones cíclicas
del benceno fueron muchas mas, todas ellas a partir del anillo hexagonal.
Klaus, que había sido alumno de Kolbe
[65]
, en un texto de Química, publicado
en 1866
[66]
, le atribuye varias formas hexagonales (fig 39 y 40), en
1887, Amstrong, Baeyer y Dewar, proponen otras (fig.41 y 42)
[67]
, pero ya existía la fórmula actual (fig.43).
Fig.39
Fig.40
Fig.41
Fig.42
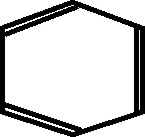
Fig.43
Lodschmid, es el primero
en interpretar el doble poder combinativo, entre dos átomos (doble enlace),
en sus fórmulas circulares de 1861
[68]
(fig 44), lo hizo al explicar el fórmula del dióxido de
carbono, con un doble trazo en la superposición de los círculos (fig.45).
Lo interesante es que es el primero en representar los átomos con diferente
tamaño.
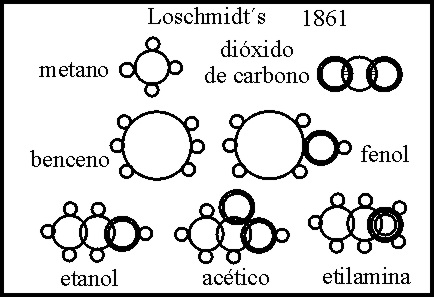
Fig.44
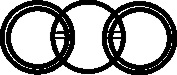
Fig.45
Otro químico
escocés, Alexander Crum Brown, alumno de Couper, en el periodo comprendido entre
1861 y 1868, interpreta las fórmulas
orgánicas, incluyendo los dobles enlaces, tal como las conocemos hoy en día,
como se ve en las
fig. 46 y 47.
Las primeras se incluyeron
en su tesis doctoral de 1861,”On the Theory of Chemical Combination”, publicada
el mismo año, en la universidad de Edimburgo. Fue el primero en formular el
eteno con doble enlace. Como se puede
apreciar, el tamaño de los átomos es igual, tal como lo había concebido Dalton
cincuenta años antes, y las estructuras son planas.
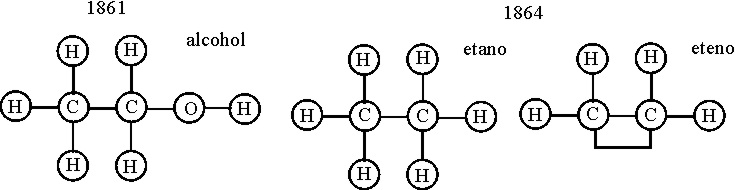
Fig.46
En 1865, Erlenmeyer
[69]
justifica la fórmula de acetileno con una triple
ligadura.
También en 1865, aparecen
otras interpretaciones gráficas del doble y triple enlace todavía influidas
por la teoría de los tipos que no prevalecieron. Las hace Wilbrand. Así podemos
observar las fórmulas del etano, eteno y etino (fig.48-50)
Después Crum Brown, Erlenmeyer
primero y Kelulé después, en 1872 emplearían únicamente el doble o
el triple trazo para representar un doble y un triple enlace.
Fig.48
Fig.49
Fig.50
Sin embargo, en la química
inorgánica también iban a surgir por estas fechas los primeros modelos moleculares
espaciales. El trabajo lo presenta Hofmann, en la Royal Institution, el 2
de abril de 1865
[70]
. En él se representan los átomos con pelotas de críquet
coloreadas, de igual tamaño. Ahí comenzaron los convenios de colores: el O,
rojo como la llama, el N, azul como el cielo, el cloro verde, como su nombre
indica, el carbono negro, y el hidrógeno blanco.
De esa forman aparecen los ácidos del cloro: clorhídrico, HCl; hipocloroso, HClO; cloroso, HClO2; clórico HClO3; y perclórico HClO4
(fig.51).
También representaría incluso
moléculas orgánicas complejas (fig.52). Tanto unos como otros, tienen estructuras
planas con átomos de igual tamaño.
A August Wilhelm Hofmann, no sólo se le debe el uso de los modelos moleculares, sino la introducción del término molar, en su libro “Una Introducción a la Moderna Química, experimental y teórica”, publicado en 1865, y los sufijos ano, eno e ino de los hidrocarburos alifáticos, como se verá mas tarde. Hofmann, guiará el congreso de Ginebra sobre nomenclatura orgánica, en abril de 1892, aunque sin poder asistir al mismo, ya que moriría poco después, el 2 de mayo.
Fórmulas
cíclicas.
Las primeras fórmulas cíclicas ya aparecen en los modelos de Dalton, a principios del siglo XIX. Después, como se ha visto, Gaudin, propone alguna fórmula cíclica para moléculas inorgánicas. Couper en 1858, introduce la ciclación, en derivados halogenados de compuestos bencénicos (salicilato de metilo). Loschmidt, en 1961 da una estructura cíclica para el benceno, aunque sin aclararla (ver fig.46) [60] , y por fin Kekulé en 1865 [61] , propone el sistema del anillo bencénico [62] (fig.35). A partir de ese momento se generalizarían las estructuras cíclicas en los compuestos llamados aromáticos.
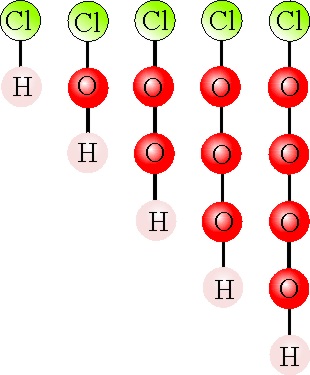
Fig.51
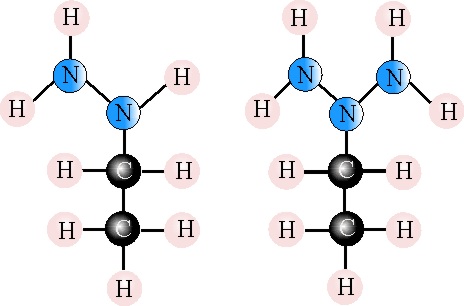
Fig.52
El auge de los modelos,
dio lugar a que algunos científicos hicieran interpretaciones jocosas, como
las realizadas en 1866, por Guthrie. Con un simbolismo especial (fig.53),
aparecen fórmulas pintorescas como la del hidrógeno sulfato de amoniaco (fig.54).
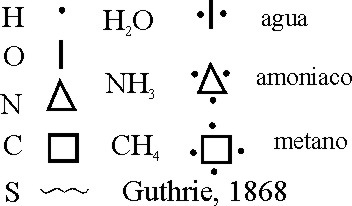
Fig.53
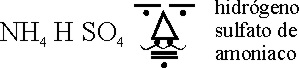
Fig.54
Un matemático inglés, Arthur
Cayley, aplica la teoría de grupos en 1874, al diseño de algunos hidrocarburos
saturados, y así aparecen por primera vez esquematizados los isómeros del
butano, y otros hidrocarburos saturados menores. A diferencia de los modelos
anteriores, los átomos de carbono e hidrógeno tienen diferente tamaño, como
se aprecia en la figura 55.
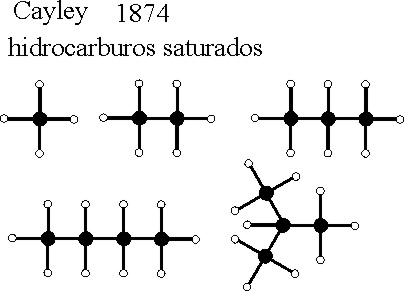
Fig.55
El
carbono en el espacio: el modelo tetraédrico
Ya Aristóteles
en De Caelo, escribe que los átomos de Leucipo y Demócrito, están formando
tetraedros, e incluso Platón en el Timeo, asocia el elemento fuego de Demócrito
a una forma tetraédrica. Vemos por lo tanto que desde hace mucho tiempo se
relacionó la estructura atómica a unas formas geométricas espaciales determinadas.
Y no solamente en los aspectos estructurales, sino relacionados con el comportamiento
químico, tal como hace Bernouilli en 1690
[71]
.
En 1758, Boscovich,
en su “Theoria”, argumenta que el equilibrio electrostático entre cuatro átomos,
exige que se encuentren en una disposición tetraédrica, y Wollaston, el médico
y químico inglés, considera, en 1808, que cuando 4 partículas rodean a una
quinta en equilibrio, deben disponerse en una estructura tetraédrica, con
la quinta en su centro
[72]
.
Ampère, en 1815, había asegurado que si el volumen de una partícula era mayor
que la suma de los volúmenes de las cuatro moléculas que formaban su agrupamiento,
éste debería ser tetraédrico
[73]
.
Butlerov,
el químico ruso de la universidad de Kazan, en 1862, es el primero en postular
que el carbono es tetraédrico y que en el metano los cuatro hidrógenos se
encuentran en cada cara del tetraedro
[74]
.
En 1863, Wislicenus,
sugiere una disposición espacial de los átomos en el ácido láctico para explicar
la isomería óptica
[75]
. Gaudin en 1865, desarrolla las ideas de Ampère, sugiriendo
la disposición simétrica de los cuatro hidrógenos alrededor
del carbono, en el metano. Dewar
[76]
y Kekulé
[77]
, independientemente desarrollan este mismo modelo en 1868.
Enmanuele Paternò, en 1869, postula también una estructura
tridimensional tetraédrica del carbono para explicar la posibilidad de isómeros
del dibromoetano. Sugiere que deberían tener “isómeros geométricos”, por la
posibilidad de rotación de los tetraedros del carbono alrededor de su vértice
común
[78]
.
Sin embargo no todos los
modelos espaciales presentados son tetraédricos pese a lo explicado, pues
Gaudin, en su “Arquitectura del mundo de los átomos”, dibuja una estructura
para el etanol, de doble pirámide hexagonal, tal como se aprecia en la figura
56, con los átomos de carbono en los vértices, y los hidrógenos en la base
hexagonal. Naturalmente este modelo no fue tomado en excesiva consideración,
aunque tiene notable importancia, al incorporar diferentes tamaños en los
átomos representados lo que no era habitual.
No es de extrañar
el tipo de estructuras prismáticas, ya que Laurent, en su Thesis de 1837,
había propuesto que el núcleo fundamental de los compuestos de carbono, era
un prisma en cuyos vértices estaban los carbonos, mientras que las aristas estaban ocupadas por hidrógenos
[79]
.
Ladenburg, alumno de Kekulé, también desarrollará en 1869,
un modelo espacial prismático para el benceno (fig.57), que no tuvo relevancia
[80]
.
Fig.56
Fig.57
Al
parecer el modelo tetraédrico del carbono
[81]
no estaba suficientemente divulgado, ya que no se comprende
el enorme revuelo que causó en el mundo científico la aparición, en 1875,
del trabajo de un profesor de la escuela veterinaria de Utrech, Jacobus van’t
Hoff, titulado :”La Química en el espacio”
[82]
, pre-cedido por su tesis doctoral. Sin embargo este trabajo
tuvo la virtud, al definir al carbono asimétrico
[83]
de justificar la isomería óptica
[84]
, comprobando las teorías de Pasteur. También justificará
la isomería geométrica, término especificado por él
[85]
, para explicar el comportamiento de los ácidos fumárico
y maleico, isómeros debido a la imposibilidad de rotación a través de la arista
de unión de los tetraedros (fig.58 y 59). La justificación implicó una representación
espacial del doble y del triple enlace, en el eteno y etino, con dos tetraedros
unidos por una arista o por una cara (fig.60 y 61).
Al mes de la aparición del trabajo de van’t Hoff, Joseph Le Bel, ayudante de Wurtz en París, expresó la misma argumentación para justificar la actividad óptica, agregando la posibilidad de la compensación interna (forma meso), para el caso de su carencia, por existir un plano de simetría.
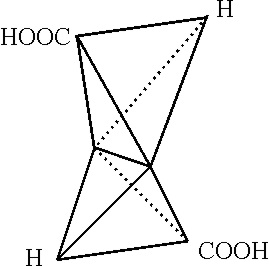
Fig.58
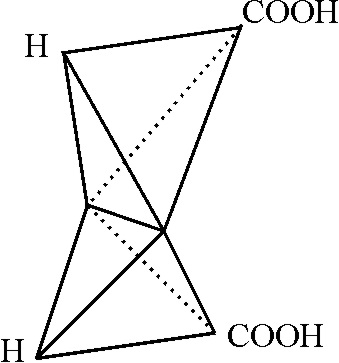
Fig.59
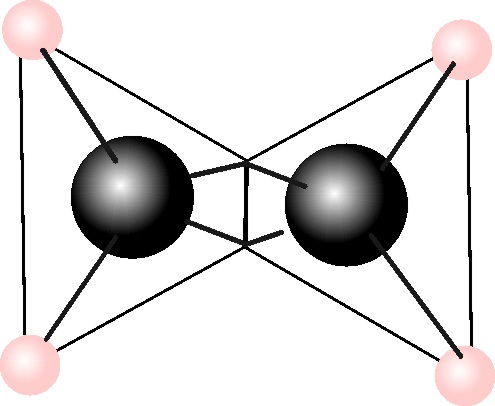
Fig.60
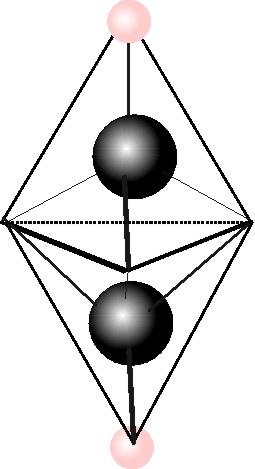
Fig.61
Vamos a contemplar el panorama
de la nomenclatura orgánica en la segunda mitad del siglo XIX. Dominan las clasificaciones por tipos , y
de Gmelin de 1848, al que se deben los nombres de éster y cetona
[86]
.
Pronto la clasificación
por tipos en los compuestos orgánicos se verá desplazada por la de Berthelot
de 1860, en carburos de hidrógeno, alcoholes, aldehidos, ácidos, ésteres,
aminas, amidas y radicales organometálicos.
Los carburos de hidrógeno
van a generar a su vez diferentes familias y Hofmann, las
clasifica en series homólogas, idea de Gerhardt en el 43
[87]
, proponiendo el nombre de alifáticos a estos hidrocarburos
que se diferenciarían por los sufijos ano, eno e ino
[88]
. Estos sufijos no surgen por generación espontánea sino
que partirían de los compuestos más característicos. El ano procedente del
metano, produciendo la familia de los alcanos, el eno del etileno,
(familia de los alquenos) y por correspondencia el ino (internacionalmente
ine) para los alquinos.
¿Y los demás
prefijos que indican 1, 3 y 4 carbonos?
El met, procede del griego
methy, a través del metílico de methy e hyle: "madera que emborracha
[89]
". Nombre que indica su extracción por destilación
y sus consecuencias; basta una dosis de 8 gramos producirá la ceguera. El
prop, procede del ácido propiónico, que se obtenía por hidrólisis de las
grasas más ligeras. Propiónico lo hace del griego proto, primera y pion,
grasa en griego. El but, procede del ácido butírico, que lo hace del latín
butirum
[90]
, mantequilla, puesto que en 1832, fue extraído por Chevreul
en forma de éster, de la manteca
[91]
.
Pero no existía
un orden en las nomenclaturas, salvo el uso de las familias ya mencionado.
Así mientras un alcohol de 3 carbonos , empleaba el nombre de alcohol propílico,
un ácido de 4, ácido butírico. También existía la forma carboxílico para indicar la función
ácido, y los hidrógenos se sustituían por radicales, así el ácido acético
también será metancarboxílico; el propiónico, etancarboxílico. Igualmente
los alcoholes con hidrógenos sustituidos por radicales, eran según Kolbe,
carbinoles. Las funciones estaban localizadas por unos números separados
por 2 puntos, en vez de comas o sin separación respecto al nombre.
Como se puede observar, a finales del siglo XIX, había un
verdadero caos en las denominaciones, aunque se hubiera conseguido ordenar
a los compuestos orgánicos en familias, y éstas en series homólogas, persistían
los nombres históricos que producían no pocas confusiones. Había que poner
fin a la teoría de los tipos y crear una nomenclatura sistemática. Así se
convocó la primera conferencia internacional sobre nomenclatura orgánica.
Nace en 1892, la nomenclatura de Ginebra.
[45]
Se lee en el trabajo:”
Independientemente de cual pueda
ser el carácter de los átomos que se unan a otro dado, el poder de combinación
de un elemento atractivo se satisface siempre con el mismo número de aquellos
átomos”.
[46]
Realmente la capacidad combinativa, fue conocida desde
muy antiguo. Sobre el 430 aC, Leucipo interpretaba la combinación química
como un enredo de átomos. Estas ideas ya aparecen en “De Caelo” de Aristóteles,
en boca del personaje Simplicio
[47]
Odling, estudió
medicina, y coincidió con Kekulé en el hospital de San Bartholomew, siendo
profesor de Química práctica de dicho hospital, y sucediendo a Faraday
en la Royal Institution. Pretendió revivir la teoría del Flogisto, asimilándolo
a la energía que se desprendía de los compuestos químicos. En una conferencia
en la Royal Intitution, usó el tipo de gas de los pantanos antes de Kekulé.
[48]
Kekulé, pertenecía a una noble familia de Bohemia, y aunque
comenzó estudios de arquitectura en la universidad de Giessen después
se decantó por la química, llegando a ser profesor de dicha universidad.
Su primer trabajo versó sobre los ésteres del ácido amilsulfúrico. Trabajó
con Gerhardt, en París, que influyó mucho en su formación. En Londres
lo hizo con Williamson, que desarrolla la teoría de la eterificación.
Es profesor en Gante, donde se haría famoso y finalmente es nombrado profesor
de la universidad de Heidelberg en Bonn, donde promocionó a toda una generación
de grandes científicos que fueron alumnos suyos.
[49] La tetraatomicidad o tetrabasicidad del carbono (“Viersbasisch oder vier atomig”), reconocida por Kekulé, aparece, sólo en una nota al pie de página en los Annalen de 1857. En los Annalen del 58, ya afirma: “La cantidad de carbono reconocida por los químicos como un átomo siempre se une a cuatro átomos de un elemento monoatómico o dos átomos de un elemento diatómico y en general la suma de las unidades químicas de los elementos unidos a un átomo de carbono es 4”. Kekulé afirmaría: ”Si no me equivoco soy el que introdujo la idea de la atomicidad de los elementos en Química”.
[50]
Hofmann, cuando
se definió en 1857, el tipo gas de los pantanos, ya explicó la capacidad
combinativa del carbono como “cuadrivalencia”.
[51] Hermann Wichelhaus, era un estudiante aventajado de Kekulé, en la universidad de Ghent (Gante) en Bélgica, que después se convertiría en su ayudante y que seguiría a Kekulé cuando se trasladó a Heidelberg.
[52]
Después de 1852,
la teoría de los tipos se había ampliado mucho, así en el tipo agua se
incluían ya, sulfuros, telururos, etc. En el tipo cloruro de hidrógeno,
los cianuros. En el tipo amoniaco, los nitruros y fosfuros y en el tipo
hidrógeno, los hidruros metálicos e hidrocarburos.
[53]
Odling será el secretario del congreso de Karlsruhe, de
1860, que se hizo para tratar de unificar los sistemas de pesos atómicos,
y de formulación orgánica.
[54]
Ladenburg, atribuye la paternidad de las funciones químicas
al francés Dumas, según publicación en los Anales de Química y Física
de 1827, luego detallado en la memoria sobre el alcohol metílico, que
escribe junto con Peligot, en la misma revista, en 1835.
[55]
Realmente, la
raya entre elementos químicos ya había aparecido en 1789, en el libro
de William Higgins “A Comparative
view of the Phlogistic and Anthiphlogistic Theories”, pero solamente
lo hacía en combinaciones del N con el O, y en un contexto de fuerzas
entre elementos, pretendiendo iniciar las leyes de la combinación química,
aunque partía de la idea de que todas las partículas que intervenían tenían
el mismo peso.
[56]
Sin embargo el
término enlace, sería introducido
por Frankland, sólo en 1866, en el texto: “Lecture
Notes for Chemical Students”
[57]
Aparece en la nota “ Sur une nouvelle théorie chimique “ de Couper, que presentó
Dumas. Dice: “Distingo dos especies de afinidades, la de
grado y la electiva. La primera es la que un elemento ejerce sobre otro
con el que se combina en proporciones definidas, y la electiva es la que
se establece con intensidades diferentes….Las afinidades electivas del
carbono, hacen que se combine consigo mismo….En el alcohol metílico el
límite de la combinación del carbono es 4, estando combinado a 3 H y un
O, que tiene un poder combinativo de 2”. Esta Memoria, se presentó
al Comptes Rendus, el 14 de junio de 1858, pero estuvo hecha mucho tiempo
antes. Lo que ocurrió fue que Wurtz al que había pedido inicialmente Couper
su presentación, ya que había sido su maestro, la echó para atrás diciendo
que las fórmulas que en ella aparecían eran demasiado arbitrarias y que
las ideas expuestas eran muy radicales. Este hecho hizo que el trabajo
de Kekulé sobre la “quadrivalencia del carbono”, se publicara antes; el
16 de marzo de ese año. Couper le echó en cara a Wurtz, que éste deliberadamente
retrasara su comunicado, por lo que Wurtz, lo expulsó de su laboratorio,
regresando a Edimburgo, donde obtuvo un puesto de investigador. Sin embargo
este hecho le causó tal depresión que ya nunca mas publicó nada. En Kirkintilloch,
pueblecito escocés, existe una lápida con la siguiente inscripción:”Esta
lápida señala el lugar de nacimiento de Archibald Scott Couper, nacido
en 1831 y muerto en 1892, cuyas brillantes contribuciones a la teoría
química, adelantadas a su tiempo le granjearon renombre internacional
y a cuyo genio, sofocado por una temprana enfermedad, se le negó la oportunidad
de consumarse”.
[58]
Fue Kolbe el
que las bautizó así.
[59]
El artículo donde
presentó Kekulé la fórmula del benceno en modelo salchicha, se titulaba
“Sur les constitutions des substances aromatiques”. Lo hizo en enero de
1865, en la Societé Chimique de
París, después de su disertación en dicha sociedad.
[60]
Al benceno, tanto
Couper como Loschmidt, también le
habían atribuido fórmulas lineales, entre 1858 y 1961.
[61]
El año anterior
a la publicación de su artículo sobre la estructura de los compuestos
aromáticos, Kekulé, no hizo nada, sumido en una profunda depresión, ya
que en el 1963, se le murió su mujer al dar a luz a su hijo. Se había
casado el 24 de junio de 1862 con Stephanie Drory, hija de un inspector
general de la empresa de gas belga; tenía 19 años; él, trece más. 20 años
después se volvería a casar con una mujer mucho mas joven que él, fracasando
el matrimonio.
[62]
Aunque en muchos
textos aparece el 1865 como el año del anillo bencénico, el mismo Kekulé,
mantenía que lo había sido, lo que ocurre es que se presentó el 27 de
enero de 1865, en una sesión de la Sociedad Química de París, presidida
por Pasteur, y presentado por Wurtz, y se publicó en dos revistas, el
Boletín de dicha sociedad, en 1865 (en forma de fórmula salchicha) y en
los Annalen de Liebig para Química y Farmacia de 1866 (137, entre pag
129 y 356) y en un libro (Lehrbuch) que comienza a publicar ese mismo
año. Realmente Kekulé en los Annalen, solo describe el benceno con un
simple ciclo hexagonal no regular, sin ningún otro elemento. Entre estos
hechos, presenta el 11 de mayo
de 1865, en la Academia Real de Bélgica, al ser nombrado miembro de dicha
sociedad, un trabajo con el título “Notas sobre algunos productos del
sustitución del benceno”, en que
se establecen los isómeros sustituidos del núcleo bencénico, y
en su publicación en el Boletín de la Academia real belga, también aparece
el anillo hexagonal simple. Será en el 66 y mejor en el año 1872, cuando
aparezca con los dobles enlaces, con una posible oscilación en las posiciones
de los mismos, estableciendo un equilibrio dinámico entre dos formas,
con lo cual ya no podían existir los dos isómeros orto, hecho que había
producido una controversia con Ladenburg. Lo que realmente movió a las
confusiones que aparecen en los textos de Orgánica, fue que en el trabajo
de 1972 (“Uber einig Condensationsproduct des Aldehyds”), aparece una
nota al pie, haciendo referencia al trabajo de los Annalen, sin año, aunque
en el texto cita el 1865, como el comienzo de la investigación. Los errores
cometidos se debieron a la superposición de los dos trabajos de los Annalen,
uno en el volumen 137 y otro en el 162. Las famosas anécdotas que contaría
Kekulé, en la fiesta que se hizo a los 25 años de la publicación del anillo,
sobre el origen del mismo en varios
sueños, uno , cuando en 1864 viajaba en un autobús londinense,
y otro cuando se durmió junto al fuego de una chimenea en su casa de Gante,
sobre serpientes que se enroscaban
formándolo, sólo tiene la referencia del que la cuenta. A nadie se la
había relatado antes, lo cual es muy extraño.
[63]
El naftaleno,
proviene de la nafta, que como se ha dicho es egipcio (agua de fuego),
mientras que el nombre de antraceno, deriva del griego antrax (carbón),
por su procedencia.
[64]
Los prefijos
orto y meta, procedentes del griego, ya eran empleados en la nomenclatura
de los ácidos. Aquí tienen el mismo sentido, orto, significa el correcto,
“el próximo”; meta, el otro, “el siguiente”. Para, indicaría el de “al
lado”.
[65]
Kolbe, no admitía las ideas de Kekulé, ni de los químicos
de la escuela francesa, aunque si lo hicieron sus alumnos, y les achacaba
el estado de desorden que existía en la química orgánica.
[66]
El texto en cuestión
era “Theoretische Betrachtungen
und deren Anwndung zur Systematik der organischen Chemie”
[67]
Todavía se da
otra fórmula , la de Ladenburg, pero al ser espacial se tratará más tarde.
También aparecerán las fórmulas con doble anillo; la de Thiele de 1899,
con anillo interior de puntos que indicaba la afinidad parcial, y la actual
de Robinson de 1925, con el círculo interior, que indica la deslocalización
anular.
[68]
En las fórmulas
circulares, los átomos de carbono era círculos mucho más grandes que los
de hidrógeno, siendo ésta la primera representación en la que se tiene
en cuenta el tamaño relativo de los átomos. Los átomos de O eran círculos
dobles y los de N círculos triples. El benceno y sus derivados aparecen
en un formato circular, aunque no en disposición de anillo.
[69]
Erlenmeyer, fue
discípulo de Kekulé, y es mucho mas conocido por el frasco de laboratorio
creado por él en 1861, que por haber sintetizado el ácido isobutírico o el aminoácido tirosina
en 1883, o haber formulado el etino tal como es en la actualidad ya en 1865. Él fue el que inventó el término
de “no saturado”, para los compuestos
con dobles y triples enlaces.
[70]
A esta solemne
presentación en la Royal Institution, acudió el Príncipe de Gales. Dos
semanas después se le ofrecería a Hofmann, la despedida del Royal College of Chemistry en Oxford Street,
de Londres, recordando su primera
clase a 26 alumnos, muchos de los cuales, ahora personas importantes,
estaban en dicho acto. El nombre de Hofmann, aparece en muchos textos,
con errores de escritura por confusión con otros grandes químicos; unos
autores lo escriben con dos ff (Hoffman), otros con dos ff y dos nn (Hoffmann),
como el Nobel de Química de 1981 (Roal Hoffmann), apellido muy usual en
alemán, y unos terceros, los menos, con
una f y una n; Hofman.( El apellido equivale al hispano Cortés)
[71]
Johannes Bernouilli, el físico suizo, en su “Disertatio de effervescentia et fundamentatione
nova hypothesis fundata”, explica que:” las partículas de oleo de vitriolo son tetraédricas
y que las partículas de potasa tienen tal forma que atacan los vértices
del tetraedro”.
[72]
En las lecturas
Bakerianas de 1812, lo detalla mas, incluso explicando el uso de un modelo
cúbico, con bolas blancas o negras en los vértices no contiguos del cubo,
según una estructura tetraédrica.
[73] Ampère había confundido partícula con molécula y ésta con átomo (en este sentido hay que leer su trabajo), que fue recogido por su pupilo Gaudin, que desarrolló sus teorías respecto a la estructura molecular.
[74] Curiosamente el año anterior Butlerov había escrito un documento fundamental “Sobre la estructura química de las sustancias”, en el que rebate las teorías de los tipos de Gerhardt y Kolbe, formulando el concepto de química estructural: ”La naturaleza química de una molécula compleja está determinada por la naturaleza de sus componentes elementales, su cantidad y su estructura química”.Este trabajo se presentó en el congreso de científicos alemanes de Speyer. Por eso se considera a Butlerov el precursor de la Química estructural. En el documento de 1862, postula que las cuatro afinidades del carbono son diferentes, pese a la posición simétrica de los hidrógenos. Este documento de Butlerov, no fue muy conocido, ya que se presentó como una nota de la Universidad de Kazan, que estaba alejada de los “circuitos” científicos europeos tradicionales, aunque otro profesor de ella, en esa misma época, se había hecho famoso en el campo de la química orgánica; Marckovnikov. También es muy conocido un tercer químico ruso contemporáneo de los anteriores, muy famoso en el aspecto musical, Alexander Borodin, que se había formado en Alemania como médico. Su tesis doctoral, defendida ante la academia rusa, la expuso mitad en ruso, mitad en latín, versando sobre: “Parecido en el comportamiento toxicológico de los ácidos arsénico y fosfórico”.
[75]
Antes Pasteur,
en 1822, para explicar las propiedades ópticas de los ácidos tartáricos,
había supuesto una estructura espacial con base en un tetraedro irregular, para justificar la asimetría
a la que atribuía dichas propiedades.
[76]
El químico escocés
Dewar escribe en 1868 en una revista inglesa
nada conocida: “Las cuatro afinidades
del carbono se pueden representar como cuatro alambres iguales que salen
del centro de una esfera, hacia los ángulos de un imaginario tetraedro
equilátero…”. Este científico fue el primero en usar modelos moleculares espaciales, tetraédricos,
hechos con alambres para explicar la química del carbono, después de Wollaston.
También descubrió el paramagnetismo del oxígeno. Se dedicaría después
a la física; uno de sus inventos que todavía pervive es el vaso de Dewar
(1892), precursor de los termo, recipientes aislantes. Se especializaría
en la obtención de bajas temperaturas.
[77]
En 1867, Kekulé
escribe en el Diario de Química alemán: “La
imperfección en el modelo (se refiere al modelo atómico del carbono), puede evitarse si en lugar de considerar
las 4 unidades de valencia del carbono en un plano, se las hace salir de la esfera atómica
en la dirección de los ejes hexaédricos, para que terminen en los planos
de un tetraedro”. Sin embargo en el Berichte (Revista creada por Hofmann),
de 1869, usa frecuentemente la disposición tetraédrica, cuando habla de
ácidos tetrabásicos, pero incide, influenciado seguramente por Pasteur,
que no es necesario que dicho tetraedro sea regular.
[78]
A los 22 años,
Paternò, estaba poniendo los cimientos a la teoría de las conformaciones
orgánicas, sin saberlo.
[79]
El hidrógeno
de las aristas, podía ser sustituido, por otros elementos y radicales.
El núcleo fijo de los carbonos, dio lugar al nombre de la teoría de los
núcleos de Laurent, antecesora de los tipos, pero con los mismos fundamentos,
porque todos partían de la sustitución del hidrógeno.
[80]
Este modelo, respondía a los resultados termoquímicos
que había obtenido Thomson, para el benceno, y no tenía el problema inicial del modelo de Kekulé, con dos posibles isómeros
orto. No sería el único modelo espacial
del benceno, ya que Rosenstiehl, en 1869, había propuesto otro, formado
por 6 tetraedros de carbono.
[81]
El modelo tetraédrico
del carbono sería demostrado en 1913, por Bragg, mediante difracción por
rayos X, pero van’t Hoff, había muerto dos años antes, el 1 de marzo de
1911.
[82]
Este trabajo fue tachado por Kolbe como “miserable filosofía especulativa”, en un
ensayo satírico publicado en 1877, con el nombre “El signo de los tiempos”. Esta furiosa crítica de Kolbe, provocó el
efecto contrario, y todo el mundo científico se fijó en lo que había escrito
van’t Hoff. Curiosamente, la cátedra de Kolbe en Leipzig, fue ocupada
a su muerte por Wislicenus, uno de los que había impulsado los trabajos
de van’t Hoff.
[83]
La asimetría
molecular responsable de las propiedades ópticas de determinadas sustancias,
fue denominada quiralidad por lord Kelvin en 1884, término que fue retomado
por Kahn, Ingold y Prelog, cuando se establecieron entre 1951 y 56, las
reglas secuenciales en la nomenclatura de los isómeros ópticos. Su origen
está en el griego keir, mano, dado que los enantiómeros
(enantio, opuesto en griego) son imágenes especulares, tal como una mano
lo es de la otra.
[84]
El año anterior
, un 22 de diciembre, había publicado una breve reseña de doce páginas en holandés, que le sirvió como
tesis doctoral titulada “Propuesta
para la proyección en el espacio de fórmulas ahora en uso en la química”,
que pasó desapercibida en el mundo
científico aunque fuera calificada con “suma
cum laude” ; tenía 22 años. En
el documento del 75 en francés, dice: “Esta
teoría está de acuerdo con los hechos (viendo el número de isómeros predichos),
si se consideran las afinidades
del carbono dirigidas hacia los vértices de un tetraedro, en el que el
carbono está en su centro… cuando las cuatro afinidades del carbono están
satisfechas por cuatro grupos univalentes diferentes, se producen dos
o mas tetraedros diferentes, uno de los cuales es imagen del otro, no
siendo superponibles”. El problema de van’t Hoff, fue que era “demasiado
joven”, para la importancia de lo que postulaba. Este hecho le impidió
a ser admitido en la Academia de Ciencias, el 27 de marzo de 1880, ya
que sacó 14 de 27 votos, necesitándose los 2/3 del total. Tuvieron que
pasar 5 años para ser admitido.
[85]
El nombre de
isomería geométrica fue creado con carácter general, por Wislicenus, incluyendo
también la óptica, ya que explicaba los isómeros del ácido láctico, como debidos al diferente
ordenamiento espacial de sus átomos. Van’t Hoff, separó ambas, especificán-dolas.
Al principio estos isómeros se denominaron
maleoideo (como el ácido maléfico) y fumaroideo (como el ácido
fumárico), hasta que 17 años después,
Baeyer introdujo el término de isomería
cis-trans (cis, latín; a ese lado, trans, latín; al otro lado). Posteriormente,
los trabajos de Kahn, Ingold y Prelog, al fijar en 1956, las reglas secuenciales
para la denominación de estereoisómeros, con cuatro sustituyentes diferentes
en los carbonos con doble enlace, el cis, será seqcis (secuencia cis),
o Z(del alemán zusammen, juntos)
y el trans, será seqtrans, o E(del
alemán entgegen, opuestos). El término de estereoisomería
había sido propuesto por Victor Meyer ya en 1890, para sustituir el “química
en el espacio” de van’t Hoff (stereo, sólido o cúbico en griego, en el
sentido de espacial).
[86]
El nombre de
cetona, deriva de primer compuesto de la familia, acetona, que lo hace
de acetum, aunque no tenga el mismo número de carbonos, por su primera obtención por destilación del
acetato de plomo (Boyle y anteriores). El éster deriva del alemán Essig-Äther,
(literal, éter de vinagre), sin embargo su origen es anterior, ya que
lo hace del griego stear, sebo, por su obtención a partir de grasas.
[87]
Una vez que se unificaron las fórmulas, se
observó que los puntos de fusión y de ebullición, de compuestos con las
mismas funciones que se diferenciaban únicamente en el número de CH2,
mantenían una diferencia constante. A estos compuestos de la misma función,
Gerhardt, los denominó serie homóloga, y en su libro “Prècis
de chimie organique” citó la serie de los alcoholes con expresión general,
CnH2n+2O, la de los ácidos CnH2n+2O2,
alcanos, alquenos y alquinos, CnH2n+2, CnH2n
y CnH2n-2, derivados halogenados CnH2n+2
Cl y sulfatos de alquilo CnH2n+2SO4.
Gerhardt, también definió las series isólogas, de compuestos ligados por
su comportamiento químico, y las heterólogas, compuestos que se podían
obtener unos de otros, sin estar relacionados por comportamiento físico
o químico.
[88]
Serían también
propuestos por Hofmann en la segunda mitad del siglo XIX
[89]
Traducción figurada
[90]
El butirum latino
lo hace del griego $@bJdD@< (queso de vaca)
que es una adaptación del scythio. Del latín lo toma el inglés, francés
e italiano. La mayoría de las lenguas de Europa del este lo hacen del
término que se emplea para la grasa.
[91]
Es curioso, que
mientras que el inglés, alemán, francés e italiano derivan su mantequilla
del latín, el español y el portugués, lo hagan de manta, por la capa que
recubre la leche, de cuyo batido se obtenía.
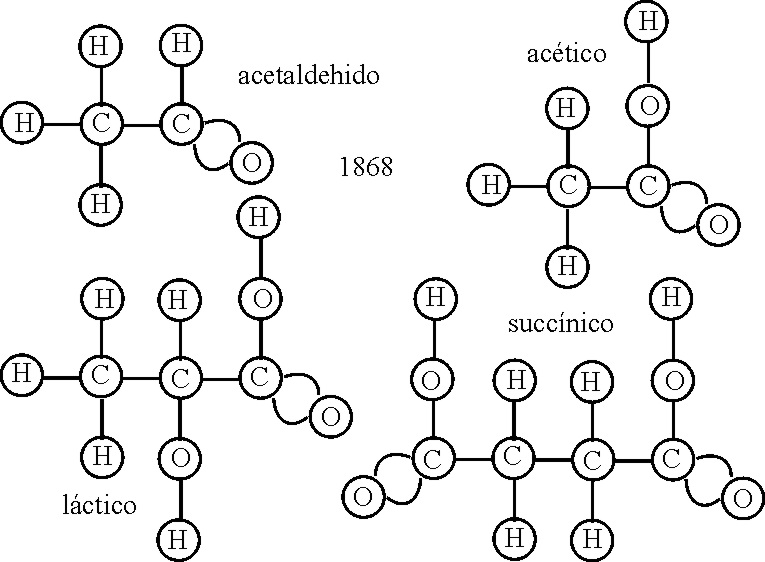
Fig.47