
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Simbolismo y nomenclatura orgánica I
Sustancias orgánicas primitivas:
orígenes y nombres.
Los compuestos orgánicos,
estuvieron asociados a los fluidos de los seres vivos, ya animales, ya vegetales,
y en principio no se les concibió otro origen (teoría vitalista). Sin embargo
este hecho no se manifestó en su nomenclatura, ya que lo que dominó para nombrar o clasificar
una sustancia fue fundamentalmente su aspecto.
El vino fue la primera sustancia orgánica conocida. Los hebreos lo llamaron yine, que significaba producto de la fermentación. De ahí surgirá el término vino, por eso su símbolo fue una V, mientras que el fermento o fermentación era un círculo [1] . Junto con los anteriores, los primeros compuestos orgánicos simbolizados fueron, la orina (fig.1), el oleum [2] (fig.2 y 3), el vinagre [3] (oxys de los griegos [4] ), por su carácter ácido (Ð>@l, oxys, significaba ácido), que después sería traducido por los latinos como acetum, con múltiples símbolos (fig. 4-8), precisamente el parecido con la >, con signo insertado dentro del círculo en el último símbolo, es lo que movió a Partington, a indicar que los símbolos griegos procedía del nombre esquematizado y adaptado.

Fig.1

Fig.2

Fig.3
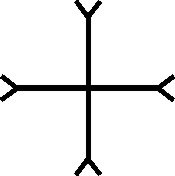
Fig.4

Fig.5

Fig.6
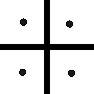
Fig.7

Fig.8
Del vino al ser calentado,
salía el espíritu del vino
[5]
, un aire con propiedades muy curiosas, que se simbolizó
de varias formas. Parece claro que al símbolo del vino (V), había que agregarle
el de aire o espíritu (fig. 9 y
10).
 Fig.9
Fig.9
 Fig.10
Fig.10
El espíritu del vino cambió
de nombre a partir del siglo XVI, aproximadamente en 1526, fecha en la que
Teophrastus Bombast von Hohenheim mas conocido como
Paracelso (Celso había sido un conocido alquimista), lo bautiza
como alcohol. El alcuhul o alcohol, antes de Paracelso, era el sulfuro
de antimonio, sólido pulverulento negruzco, que
emplearon los pueblos árabes, y antes los egipcios, para que sus mujeres,
se ennegrecieran las cejas y sombrearan sus ojos dándoles profundidad. El
nombre de alcuhul, derivado de al kahal,
que lo hace de khul, hace referencia a algo que
ennegrece
[6]
. ¿Qué tiene que ver el alcohol de antes de Paracelso como el de después? La apariencia no puede ser más
opuesta. Veamos donde está la analogía. El alcohul
o alcohol, era un polvillo negro muy fino que enseguida desaparecía con un
simple soplido; el espíritu del vino, también era algo que se iba y desaparecía
del vino, simplemente con el aire. Este hecho proporcionará el sufijo ol, en multitud de compuestos orgánicos; los alcoholes
[7]
.
El alcohol y el vinagre
(vino agrio) derivados del vino son los compuestos orgánicos más remotamente conocidos, que el hombre va a tratar
para su uso. Sus nombres bíblicos, o egipcios no han perdurado; los sumerios
lo llamaron guhlu. Existía otro vinagre, dentro
del mundo alquímico, conocido como vinagre de los filósofos y agua cuarta, que no tenía nada que ver con
el vinagre, esto es con el acetum.
Otro producto extraído del vino era el agua de la vida o aqua ardens (aguardiente) [8] , remedio muy empleado para curar enfermedades [9] , cuyo símbolo se da (fig. 11).
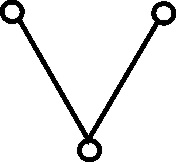
Fig.11
El vinagre (acetum de los latinos), fue un producto a partir del cual
se hicieron múltiples compuestos y símbolos. Su identificación como ácido
acético fue hecha por Stahl, a principios del siglo
XVIII, que obtuvo el ácido acético glacial por oxidación del alcohol.
Durante un tiempo se creyó
que estaba en varias formas de oxidación, por eso a la menor se le llamó ácido
acetoso (propuesto por Lavoisier), que incluso fue
simbolizado por Dalton (fig.12).
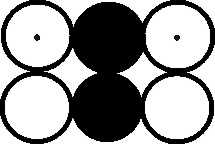
Fig.12
Enseguida se combinó al
ácido acético con todas las bases salificables posibles, obteniéndose
curiosos compuestos con nombres no menos curiosos como: tierra foliada mineral
(acetato sódico), en su combinación con sosa. Combinándolo con potasa daba
una sustancia con múltiples nombres como: tierra foliada de tártaro secretísima
de Muller, arcano de tártaro de Basilio Valentin
y de Paracelso, magisterio purgativo de tártaro
de Schroeder, sal esencial de vino de Zwelfer,
tártaro regenerado de Tachenius, sal diurética de Sylvius
y de Wilson. Todos estos nombres corresponden al acetato potásico.
Combinándolo con cal producía:
la sal de creta, sal de coral, sal de ojos de cangrejos. Si era con amoniaco
(el álcali volátil), se obtenía el espíritu de Mendererus,
también llamada agua de Minderer.
Y otras muchas más combinaciones
que resumiremos:
El azúcar de Saturno (acetato
de plomo)
[10]
, la tinta simpática de Cadet
(acetato de cobalto), los cristales
de venus, verdette o cardenillo (acetato de cobre)
[11]
, el fósforo líquido de Cadet
(acetato de arsénico), el azúcar de bismuto de Geoffroy
(acetato de bismuto), la tierra foliada mercurial
(acetato de mercurio). Como se puede observar los nombres siguen las
pautas explicadas en capítulos anteriores.
Igualmente el alcohol va
a generar como derivado el alcohol dehydronegatus
[12]
, cuya simplificación conocemos como aldehido,
que antes era femenino (aldehida), por similitud
con las cetonas. Todavía podemos leer en los libros que en la clasificación
de los compuestos orgánicos, un grupo muy importante era el de las “aldehidas”.
En el "Tyrocinium Chymicum", especie
de biblia química del siglo XVII, publicada en 1624,
años después de la muerte de su autor, el inglés John
Beguin, aparece un compuesto con el nombre de "espíritu
quemante de saturno", que nadie identificaría con su nombre vulgar
actual: la acetona.
¿Por qué ese
nombre?
Su análisis revelará cómo se bautizaban los compuestos orgánicos,
con los nombres que actualmente nos llaman tanto la atención. Espíritu, porque
es volátil, y en caliente estaría en estado gaseoso (todavía no se había creado
el término gas). Quemante, porque ardía fácilmente, y uno se quemaba al prenderle
fuego. Pero lo que más llama la atención es lo "de saturno".¿Qué
tendrán que ver los astros con dicho compuesto?.Para comprenderlo mejor hay
que remitirse al método empleado para obtenerlo; destilación de lo que actualmente
llamamos acetato de plomo, y antes era el "azúcar de saturno",
o vinagre de saturno. ¿Cuál es la relación entre el metal plomo y el planeta
saturno? En la alquimia había una correspondencia entre los planetas del sistema
solar y los metales más representativos. El plomo tiene
la característica propiedad popular de ser un metal pesado, al que
se supone que se desplazará lentamente, tal como lo hace el planeta Saturno
en su órbita, pues es el más lento del sistema solar. Tanto es así que en
alemán, plomo es blei, nombre que también se le da al planeta. La acetona,
generará su nombre actual, propuesto por Gmelin,
225 años más tarde, derivándola del nombre del vinagre latino; acetum,
que dio el ácido acético. Curiosamente, éste ácido significaría doblemente
ácido, puesto que acetum, significa ácido en latín,
como óxido lo reitera en griego.
Otro producto
muy antiguo es el jabón. Plinio (I d.C), en su historia natural, adscribe su invención al pueblo
galo
[13]
, sin embargo aunque no era conocido por griegos ni latinos,
otras civilizaciones anteriores lo emplearon, pues ya en el papiro de Ebers
(1500 a.C), se estudia su obtención hirviendo aceites y grasas con
cenizas de plantas
[14]
. El término jabón es muy interesante, porque procede de
la raíz indoeuropea seib, e incluso se
encuentra en toccario (lengua indoeuropea extinguida
hace mas de 2000 años), por eso se denomina igual o con similar raíz en la
mayoría de las lenguas europeas
[15]
. Lo curioso es que en árabe era al-sabun,
y por eso en el medievo en España se denominaba
asabon, por lo tanto fue una raíz europea tomada por el árabe.
Su símbolo alquímico fue muy empleado (fig. 13),
aunque la higiene brillara por su ausencia en esos tiempos.
Los egipcios, caldeos y
sumerios, especialmente los primeros empleaban “jabones” antes y después de
comer
[16]
, que denominaban anchir, sin
embargo esos jabones, no tenían relación con los actuales, ya que eran sales
inorgánicas, tales como los carbonatos sódico y potásico (nitro, neter
y borith).
Otro compuesto con gran
tradición orgánica es el tártaro, que aunque se aplicó a cualquier depósito,
sin embargo se identificó con el que formaban
los vinos especialmente dulces. Debido a que a estos depósitos se les
achacó la enfermedad de la gota, que causaba muchos dolores, se le denominó
así (el tártaro era el infierno de los latinos), teniendo múltiples símbolos
(fig. 14 -20)
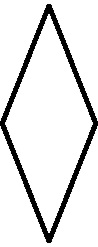
Fig.13
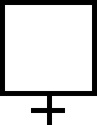
Fig.14
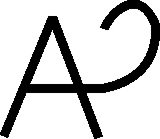
Fig.15
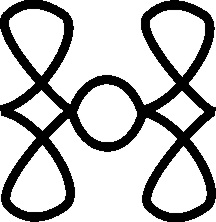
Fig.16
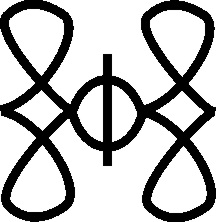
Fig.17

Fig.19
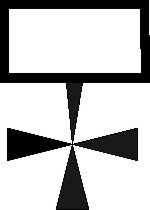
Fig.20
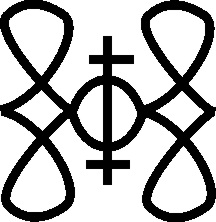
Fig.18
El tártaro aparece en los
escritos de los alquimistas árabes
[17]
, después en los escritos de Paracelso
[18]
, y de van Helmont. A partir de
1600, se describe el tártaro emético que era una sal de tártaro y antimonio
[19]
. Sin embargo las sales de tártaro ya eran conocidas y también
simbolizadas desde antes, tal como la sal de calcio (fig.21)
y el cremor tártaro (tartrato ácido de potasio).
En 1540, Valerius Cordus, obtiene el “aceite
dulce de vitriolo” pues lo había obtenido
con aceite de vitriolo (ácido sulfúrico) y espíritu destilado (etanol)
[20]
. Este compuesto se denominó éter, del griego aithen
por lo fácilmente que ardía, y se conocería como éter sulfúrico derivado de su obtención. Así se generará con
el paso del tiempo el nombre de alcohol
etílico y a través de él, el prefijo et, que se atribuye a todas las agrupaciones
de dos carbonos, aunque la fórmula asignada en principio a este compuesto
no tenía dos carbonos, como se verá.
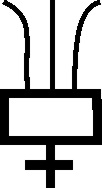
Fig.21
En 1590, se
descubre un compuesto que será famosísimo en el mundo orgánico: Las flores
de benjui (Blas de Vigenère,1590 ,"Traite du fer et du sel",
publicado en 1618). Se extraía de un árbol oriental el benjui,
y al calentarlo sublimaba en agujas blancas (flores), del benjui,
que procede del árabe lubenyawi (incienso de Java),
derivarán benyawi, benjavi,
benjui, benzui, benzina
y benzol, padres directos del benceno. Ese olor característico de la resina
del árbol, es lo que hará que la química del benceno se denominará aromática,
aunque modernamente su aromaticidad química sea
algo bien distinto. Por muy bien que huela, no se debe hacer, pues
elimina los glóbulos rojos de la sangre.
El benceno
actual, se conocería como bicarburato de hidrógeno
(nomenclatura sistemática de Lavoisier), cuando
Faraday lo extrajo en 1825, de los residuos del gas del alumbrado
de Londres que se producía a su vez del aceite de ballena
[21]
. Sin embargo parece ser que ya en 1667 había sido obtenido
por Glauber, junto con el fenol
[22]
, en la destilación de carbón mineral, ya que
lo describe como un “oleum
ardiente de color rojo que seca y cura poderosamente las úlceras húmedas”.
Su nombre de benzol y de ahí a benceno, sería propuesto por Hofmann,
20 años después.
Mucho más antiguo es el origen de otro compuesto orgánico
como la nafta, que producirá el naftaleno y todos sus derivados. Nada menos
que del antiguo Egipto, donde Na era agua y phtha fuego. Ese nombre revela una propiedad característica,
su combustión. Por eso se empleaba en los templos del dios del fuego (Ptha).
Desde 1675, año en que
Lemery comenzó la clasificación de los compuestos orgánicos
hasta nuestros días, han pasado más de tres siglos.¿Por
qué Lemery atribuía el adjetivo "orgánico"
[23]
a un compuesto, asignándole un papel activo en el reino
animal o vegetal? Simplemente por su apariencia. Todo sólido duro, con aristas
y apariencia rocosa, era no orgánico; lo contrario, sería orgánico. Así vemos
al tricloruro de antimonio, clasificado de orgánico, sólo porque era untuoso
como manteca, por ello lo denominará "manteca de antimonio",
nombre ya comentado. Conviene recordar que los derivados
del antimonio, eran unas de las panaceas curalotodo del siglo XVI y XVII
[24]
.
Van Helmont,
a principios del XVII, había obtenido una especie de agua al destilar la madera.
Boyle, cincuenta años después demuestra que esta
agua, es una especie de vinagre y de espíritu del vino, y lo llama “espíritu
adiaforético”, que sometido a nueva destilación,
producía un espíritu inflamable que denomina alcohol de madera. Taylor en
1812 lo denomina éter piroleñoso
[25]
, cuyo nombre ya indica sus características y procedencia.
Por fin los franceses Dumas y Peligot en 1834 lo
denominarán alcohol metílico
[26]
.
En las Mémoires de l’Academie
des Sciences francesa, de 1688, aparece con autoría
de un médico francés, Duclos, la primera referencia
a un ácido extraído del jugo de la
acedera, cuando se exprime
[27]
. Precisamente el nombre de esa planta va ligado a las características
ácidas de dicho jugo, por eso a dicho ácido que sería poco mas tarde descrito
y estudiado por Boerhave, se le denominó oxálico,
con el prefijo ox, tal como la planta, oxalis (obsérvese la
raíz indoeuropea ak=ox).
Otro ácido
que se había obtenido mucho antes por la destilación del jugo de planta, fue
el succínico, extraído del succino, karabé o ámbar
amarillo. Fue encontrado a principios del siglo XVII, por Oswaldo Croll, aunque sería estudiado mucho mas tarde por el sueco
Scheele, tal como el oxálico
[28]
. No sería el único ácido orgánico obtenido por el químico
sueco. También extrajo de la leche agria, el ácido de la leche (ácido láctico),
de las manzanas, el málico; de los limones, el cítrico y de las nueces de
agalla, el gálico
[29]
. Tratando aceite de oliva con litargirio, obtuvo un líquido
siruposo, que llamó aceite dulce (más tarde y por
ese motivo, glicerina). Incluso de los cálculos urinarios, y al mismo tiempo
que otro químico sueco Tobern Bergman, obtuvo el ácido
que llamó lítico (lithos, piedra) y que después
sería úrico (mismo origen que orina, o sea del griego oύρέω,
en el sentido de hacer aguas). Todo ello entre 1776 y 1786.
Precisamente será Bergman, el primero en producir artificialmente un compuesto
orgánico, setenta y cinco años antes que Wöhler
sintetizara la urea en 1828. Sería en el trabajo sobre el ácido del azúcar,
que obtiene tratando azúcar con ácido nítrico, pero cree al principio que
se trata de un ácido similar al de la acedera (oxálico).
En 1683, el rey de Suecia, Carlos XI, funda el laboratorio químico modélico (el mejor de Europa, en su tiempo), en Estocolmo, y le encarga la dirección a Urban Hierne [30] . El objetivo del laboratorio era estudiar las tierras más favorables para los cultivos, encontrar nuevos remedios médicos, buscar nuevos materiales que resistieran los incendios etc. Los dos primeros trabajos publicados por Hierne salidos de estas investigaciones fueron “Sobre el ácido de las hormigas” y “Sobre el aumento de peso de los metales por calcinación”. No sería el primer trabajo sobre el ácido de las hormigas, porque en 1670, De Wray ya había sometido a las hormigas a destilación. Scheele lo obtendría por síntesis en 1786 [31] .
El hidrocarburo con más
antigüedad en la literatura química, es el gas de los pantanos de Van Helmont, descrito en 1600. Después sería llamado aire inflamable
por Volta en 1777, año en el que Bergman creó la
llamada química orgánica. Su inflamabilidad producía muchas víctimas en las
minas de carbón
[32]
, por eso su nombre de "feu
grissou" (fuego gris) que dio grisú. En 1769.
Lavoisier lo llamó gas hidrógeno carbonado. Sólo
recuperaría su nombre actual, metano, en 1785, pero no
porque tuviera un carbono, porque su fórmula inicial no se parecía
en nada a la actual.
Su fórmula símbólica propuesta por Dalton es
la dada en la fig.22
La primera clasificación
de los hidrocarburos se hizo con parafinas, olefinas y acetilenos. En 1830, Reichenbach,
había aislado unos hidrocarburos con muy poco reactividad, que llamó parafinas
(poca afinidad).
Fourcroy en el XVIII,
había llamado gas oleificante, a lo que ahora conocemos
como eteno porque
por su cloración se producía una especie de aceite (cloroetano) denominado aceite de los holandeses. Su fórmula
simbólica propuesta por Dalton
[33]
es la dada en la
fig.23.

Fig.22

Fig.23
Por eso, su nombre: gas
que producía aceite. Antes fue eterina, puesto que
se producía en la obtención de los éteres, al tratar alcohol etílico con ácido
sulfúrico (Berzelius,1825),
aunque su primer nombre, cuando Becher lo produjo
en 1669, no se registró. En la clasificación de Berthelot,
sería el hidrógeno carburado pesado. Los acetilenos derivan de este compuesto,
cuyo nombre tiende a confundir a los estudiantes en su insaturación.
El acetileno descubierto por Davy oficialmente en
el 1836 (antes en 1808, lo había descrito), en la obtención del potasio a
partir de carbonato potásico, y bautizado como klumeno,
también debe su nombre a Berthelot, por que lo consiguió producir a partir de etileno
(eteno) tratándolo con alcohol o éter en un tubo
al rojo, creyendo que se acetilaba, de ahí el famoso
nombre que tanta guerra sigue dando.
Sin embargo una cosa era
la nomenclatura o asignación de un nombre,
y otra la simbología de dicho compuesto, ya que Dalton había dado una proporción atómica mínima.
La
formulación química y la simbología orgánica.
El primer intento de formulación
casi espacial de los compuestos orgánicos, dentro de la simbología general
química, fue el de Dalton, quien inventó los modelos
moleculares espaciales. Al adaptar la simbología inorgánica a la orgánica,
llega a representar sustancias orgánicas complejas como el alcohol, el azúcar,
la albúmina y la gelatina (fig. 24 a 27)
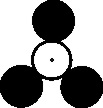
Fig.24
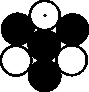
Fig.25
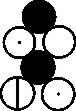
Fig.26
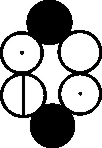
Fig.27
La formulación
y simbología de los compuestos orgánicos, tenían el problema de la capacidad
del carbono de unirse a si mismo, por lo cual las fórmulas reales eran muy
diferentes a las empíricas, necesitándose los pesos atómicos de los elementos
constituyentes, para determinarlas. Y ahí estuvo el problema.
Desde 1812,
hasta finales de siglo, se emplearon diferentes medidas de los pesos atómicos
y aunque Berzelius estableció una escala muy parecida
a la actual, los químicos alemanes, tomaron el peso atómico del C, como 6,
y el del oxígeno 8
[34]
, y así se plasmaron en todos los textos. El motivo estaba
en el método empleado para su cálculo. Por ejemplo Dumas usaba el procedimiento
de las densidades en fase vapor, pero partiendo de la idea de que las moléculas
de los gases simples, se dividían en la combinación
[35]
. Las consecuencias fueron que la simbología de las fórmulas
partía de un número de carbonos doble del real. En algunos casos se especificaba
en la fórmula esta característica, con una raya debajo del símbolo, o partiéndolo,
por eso cuando aparecían C y O, así reflejados, se sabía que eran átomos dobles.
Otras veces, se indicaba al lado de la fórmula el peso atómico o equivalente
del C o H que se tomaba, pero la mayoría de las veces no se indicaba nada.
Unos químicos empleaban el peso atómico de Berzelius,
otros el de Dumas. Otros el equivalente de los elementos (que no tenía nada
que ver con el peso equivalente actual) sino que se identificaba con el atómico.
Además Berzelius, había definido el equivalente
[36]
de un ácido orgánico la cantidad que se unía a una molécula
de óxido de plata. Lo malo era que la fórmula de referencia que se tomaba
para esta sustancia, era de la Berzelius, que también
aparecía en el handbook de Gmelín, o sea AgO.
Por lo tanto las fórmulas
de los ácidos orgánicos deberían ser dobles. Así vemos en la tabla 1 la evolución
en la formulación de 5 sustancias cuya nomenclatura se trató.
En 1834, también aparece el trabajo de Dumas, sobre la aparición de un radical que Berzelius llamó metilo, de fórmula C2H3 o C4H6, con C barrado. Sin embargo este mismo radical, obtenido al año siguiente por Regnault, por procedimiento diferente, lo denomina aldehidene y Liebig al duplicado C4H6, con C barrado, acetilo.
En 1838, Liebig,
define por fin el radical orgánico como un constituyente invariante en una
serie de compuestos que puede ser reemplazado en ellos por elementos, que
a su vez pueden sus sustituidos por cantidades equivalentes de otros elementos.
Todavía surgirá un radical
que luego sustituirá al hidrógeno en muchas fórmulas; el otilo OC2H3
[41]
Tenemos en 1840 fundamentalmente
tres radicales hidrocarbonados que formarán parte
de muchas familias, con fórmulas normalizadas en la misma nomenclatura (tabla
2):
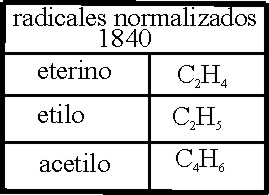
Tabla 2
Pero eso no
era todo. Los equivalentes se tomaron a partir del volumen de gas comparado
con el volumen de hidrógeno, en las mismas condiciones, y como se ha dicho
hubo dos tendencias, tomar el hidrógeno como H2 y como H4,
y así surgieron las fórmulas de dos volúmenes, las primeras y las de cuatro
volúmenes, las segundas. Berzelius usó las primeras
mientras que Liebig, el otro químico más influyente
en esa época usó las segundas. Sólo en 1843, Gerhardt
que había sido ayudante de Dumas, unificará los criterios. Tomará como fórmula
del óxido de plata Ag2O, con lo cual
las fórmulas de los ácidos orgánicos y sus derivados había que dividirlas
por 2, pero usando los pesos atómicos de Berzelius
(C,12- O,16- H,1), adoptando las fórmulas de dos volúmenes, con
lo cual las de los compuestos orgánicos
ya se parecieron mas a las actuales. Sin embargo aunque el tiempo le daría
la razón, el proceso no fue nada fácil porque
todos los químicos alemanes siguieron el criterio de Liebig, y lo que era más influyente, toda Europa estudiaba
la química orgánica a través de los tratados alemanes
[37]
.
Laurent, otro ayudante
de Dumas y amigo de Gerhardt, adoptó en 1846 los
pesos atómicos de éste dándoles el significado de la más pequeña cantidad
de elemento presente en un mol de cualquier compuesto
que lo contuviera.
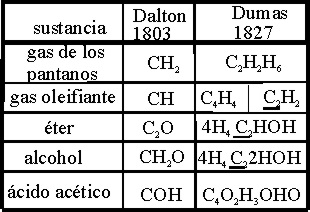
Tabla 1
Los
Radicales orgánicos.
El uso de radicales orgánicos
en las fórmulas fue un intento de poner orden, pero consiguió todo lo contrario.
En el tratado elemental
de Química de Lavoisier, y en su formulación y nomenclatura
sistemática, se inicia la teoría de los radicales
[38]
. Esto es, las sales estaban compuestas de un radical (parte
ácida), y de una base salificable, tomando el nombre del radical.
En 1816 Robiquet y Colin destilando alcohol
con ácido muriático, obtienen el éter muriático que consideraron un compuesto
de gas oleificante y ácido muriático y por lo tanto
con fórmula:
C2H5Cl = C2H4+ HCl
Sin embargo en 1832, Berzelius al considerar que el gas oleificante no tenía propiedades alcalinas y por lo tanto no debía unirse al ácido muriático, propone que lo que se forma es un radical, que llama eterino de fórmula similar al gas oleificante [39] . Pero dos años después Liebig, confirma que el radical procedente del gas oleificante, no tiene esa fórmula sino C2H5, o C4H10, con C barrado, llamándole etilo y después aetilo [40] , siendo el C4H8, el eterino.
La
sustitución.
Un hecho accidental
va a ser crucial en la formulación orgánica. En una recepción real en el palacio
de las Tullerías de París, se advierte una atmósfera
muy cargada, en la combustión de las velas, produciéndose unos vapores sofocantes.
El problema se le plantea al químico más importante de Francia en aquellos
momentos, que era Dumas, y éste interpretó en 1834 que la cera de las velas
había sido decolorada, y que los humos tan sofocantes no era mas que gas muriático.
¿Cómo se había formado? Sencillamente por sustitución (Dumas le llamó metalepsia),
del hidrógeno del hidrocarburo por cloro. Naturalmente este hecho causó sensación
en el mundo químico, y el enfado de Berzelius. ¿Cómo
un elemento electronegativo iba a sustituir a otro positivo? Era un sin sentido
químico. Propone que se formó por una cópula entre el ácido oxálico y el cloruro
de carbono.
Sin embargo poco tiempo después Melsens, ayudante de Dumas, obtiene
el ácido acético, a partir del tricloroacético
por sustitución del cloro, confirmando el proceso anterior al realizarlo
al revés.
Los
tipos.
La posibilidad de la sustitución el hidrógeno por un radical, hace que los químicos de la escuela de Dumas, Laurent, Gerhardt [42] , y Regnault crearan la teoría de los tipos [43] , y se originara un nuevo sistema de formulación a partir de 1840. Primero fue Dumas el que sugirió que en las sustituciones había un átomo o grupo que se mantenía constante, dividiendo los tipos en mecánicos y químicos, sería la “vieja teoría de los tipos”. Después serían Laurent y Gerhardt, los que aportaron los núcleos básicos sobre los que cabía hacer las sustituciones (y se llamó teoría de los núcleos), completándolos Regnault y Williamson que aportó el tipo agua.
Los 4 tipos
generalizados por Gerhardt
entre 1850-4, fueron: agua, amoniaco, hidrógeno y ácido clorhídrico constituyeron
el “système unitaire”,
que dominó parte de la ciencia europea durante casi 20 años.
El tipo agua (tabla 3)
daba lugar a la formulación de alcoholes, éteres y ácidos. El amoniaco (tabla
4), a aminas
[44]
y amidas. El hidrógeno (tabla 5), a hidrocarburos, aldehidos
y cetonas, y el ácido clorhídrico (tabla 6) a los derivados halogenados.
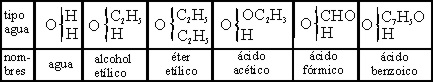
Tabla 3
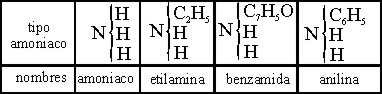
Tabla 4
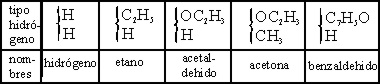
Tabla 5
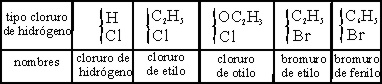
Tabla 6
En 1852, Williansom generalizó
la teoría de los tipos para compuestos
inorgánicos, a partir del tipo agua tal como se muestra en la tabla 7. Ampliándola
al año siguiente, junto con Odling a los tipos de agua doble y triple (tablas 8 y 9).
De esa forma se formularon múltiples compuestos inorgánicos.
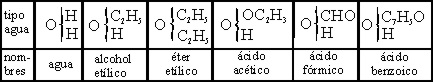
Tabla 7
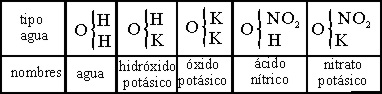
Tabla 8
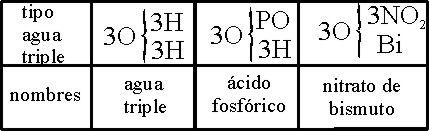
Tabla 9
[1]
El término yine en hebreo y semita como producto de la fermentación,
derivado del verbo yavane (hacer efervescencia)
originará el @Í<l(oinos) griego que a través de woinom,
producirá el vinum latino que se extenderá a
la mayoría de las lenguas europeas.
[2]
El oleum latino, procede del griego ¦8"4(oliva), que dará el oil inglés, huile
francés, alew
gótico, olej polaco etc. El aceite español
y azeite portugués,
proceden del árabe zait, que lo hacen de zaitun, oliva.
[3]
En árabe es khall y khometz, relacionado con
la fermentación que es khamir, mientras que fermento es khamets.
Es interesante observar que la fermentación va ligada al vino, al alcohol
y al vinagre. La producción de burbujas por un medio natural llamó la
atención enseguida a los primeros químicos (alquimistas). En un ladrillo
cuneiforme, procedente de Nippa, que corresponde
a la primera dinastía babilónica (2000 a.C.), ya aparecen referencias
a la fermentación natural y a como se inhibía con sustancias derivadas
del cobre.
[4] Éste será el origen del término óxido y posteriormente oxígeno.
[5]
El espíritu
del vino, fue recomendado por Geber (VIII.d.C.), como “disolvente de las sales metálicas”
[6]
Véase en la
sección orígenes de esta misma
web “el origen del nombre del antimonio”.
[7] Boyle hizo el primer análisis del alcohol y señaló que contenía un 30% de agua. El alcohol puro fue descrito sólo en 1796, por Tobías Lowitz, siendo llamado por Richter alcohol absoluto. Solo en 1823, Gaudin da la fórmula actual C2H6O.
[8]
El primer método
de obtención del aqua ardens,
aparece en el tratado de Marcus Graecus,
“Liber ignium” (siglo
VIII d.C. fue traducida al latín en el XIV). En él se relata, que: “para prepararlo se tomaba vino viejo, un cuarto
de vino dulce, dos onzas de azufre en polvo, dos libras de tártaro procedente
de un buen vino blanco, dos onzas de sal común, todo ello en una cucúrbita
bien plombeada, y después se destila en un alambique,
obteniéndose un buen aqua ardens que debe conservarse en un vaso bien cerrado”. Rhazi (siglo IX),
emplea para obtenerla, un “ocultum” (posiblemente
granos de cereal), cuya fermentación lo produce.
[9] En un manuscrito francés de la época (siglo XV) que se conserva en la Biblioteca nacional de París, se puede leer que “el agua de la vida previene de los dolores producidos por el enfriamiento, y por gran abundancia de fluidos en los ojos (ojos lagrimeantes) y también para aquellas personas con mal aliento…”. Llegó a ser considerada como una panacea que curaba hasta las enfermedades incurables. Sin embargo en el siglo siguiente, debido a los excesos fue considerada aqua mortis.
[10]
El acetato de plomo, era obtenido ya por los griegos,
introduciendo en toneles con vinagre, láminas de plomo. Lo conocían como
psimmythion. Los romanos como cerusa. En la alquimia; blanquet. Era un pigmento blanco muy conocido; el “blanco
de plomo”. Sin embargo a veces se formaba accidentalmente, porque para
corregir la acidez del vino y mejorar su color, se le agregaba litargirio
(óxido de plomo), con lo cual se formaba el azúcar de saturno que era
muy venenoso.
[11]
El acetato de
cobre, era conocido por los griegos. Empedocles
lo llamó \@l. Los latinos, lo conocían como aerugo,
derivado de aes-aeris,
nombre del metal por excelencia (véase el “origen del nombre del oro”,
y “origen del nombre del cobre”, en la sección orígenes. También recibió
muchos mas nombres como chalcanthos, chalcitis, scolecia, misy y siry. Sin embargo
fue confundido con el carbonato de cobre, muy llamativo por su color verde,
por eso se le llamó verdigris
con un símbolo específico.
[12]
El producto obtenido
por deshidrogenación del alcohol, ya había sido
observado por Scheele en 1774. El término fue
propuesto por Berzelius en 1835, generalizando
estos compuestos a la familia de las aldehidas.
Este nombre se extendía para aquellos compuestos producidos por deshidrogenación
del alcohol. Así por ejemplo cuando Dumas trata alcohol con cloro, que
le quitaba hidrógeno sin sustituirlo, obtiene una aldehida
o ether acétique de
fórmula C8H8O2, con carbono barrado (carbono
como átomo doble).
[13]
En su Historia Naturalis,
V28 cita ”….prodest
et sapo; Gallorum
hoc inventum rutilandis capillis; fit ex sebo et cinere..duobus modis,
spissus et liquidus,
uterque apud Germanos
maiore in usu viris quam feminis”.
Por lo tanto los galos empleaban
el jabón para enrojecer sus cabellos como los Germanos.
Galeno (Siglo II dC), recomendaba el
jabón como medicamento y preventivo, siendo los mejores los del pueblo
de Mattium en Germania. Se vendían en pomadas y como bolas. Las
bolas de Mattian eran las más usadas por las
mujeres romanas.
[14]
En un texto de la tercera dinastía
de Ur (2200 a.C) se
especifica que se emplea para lavar ropa, obteniéndose con 1 qa de aceite y 5 y medio de qa de
cenizas de mastakal (planta similar al kali, usada para extraer potasa). Pese a esos testimonios
antiguos, sólo en 1666, Tachenius estableció
que los jabones estaban formados por un ácido procedente de una grasa,
con un álcali, en un proceso que sería llamado por ello saponificación.
La nominación y confirmación la hizo Chevreul
(uno de los químicos más longevos, ya que murió a los 103 años) en 1816.
[15] En el antiguo germánico es seife, en británico soavon, en rumano sapun, en servocroata sapun, en letón ziepes etc.
[16]
El mayor uso de los “jabones” era como
medicamento, así aparece en la literatura babilónica y egipcia, para curar
sarnas, enfermedades de la piel, venéreas y también quemaduras.
[17]
La primera referencia sobre el tártaro aparece en el tratado
“Extractos hechos para un filósofo cristiano anónimo”, de Myriam la judía,
de la escuela de Alejandría, en una relación de sustancias empleadas en
la obra alquímica, junto con el aceite ricino, el agua del acetum,
el ácido de sal marina etc. También aparece en los escritos de Geber con el nombre del sal
tartari. Lo obtiene de la destilación del
vino.
[18]
Paracelso es el autor de la
teoría del tártaro, según la cual igual que el vino originaba depósitos,
el organismo humano también los creaba y eran los causantes de las enfermedades.
También supuso que la digestión estaba dirigida por un ser espiritual que existía en el estómago y se denominaba Archeo. Recomienda los baños minerales artificiales, empleando
sales de tártaro entre otras sustancias. Quizá lo mas interesante es que
crea la Química médica (Iatroquímica).”El hombre es un compuesto químico, y sus enfermedades
son debidas a una alteración en su composición. Es necesario hacer por
lo tanto medicamentos químicos para combatirlas”.
[19]
Lo describe por
primera vez Hadrian Mynsicht,
antes que Paracelso. Se producía como residuo
en las cubas de vino, cuando éstas se
hacían con arcilla mezclada con cales de antimonio. Se empleaba como vomitivo,
de esta forma el enfermo echaba fuera los “malos humores”, por lo tanto
actuaba como una purga. Era una frase muy común en la medicina del XVI
“No hay mas remedio que el antimonio (tártaro emético) y las sangrías”.
[20]
Se describe
así su obtención: “Sabiendo que
en la destilación de la mezcla de aceite de vitriolo y espíritu del vino
se obtienen varias sustancias, primero hay que picar con un alfiler la
vejiga conectada al boca del alambique, para saber por el olor los licores
que se desprenden a medida de que sucede la destilación. Primero sale
el espíritu del vino seguido de un poco de agua de Rabel (mezcla de alcohol
y óleo de vitriolo. En segundo lugar se desprenden unos vapores blancos,
que contenía el éter y que no podían ser absorbidos. En tercer lugar,
una sustancia con un olor a azufre muy penetrante”. Lo denomina: oleum vitrioli dulce verum. Su descubrimiento
se atribuyó mas tarde a Frobenius (1730), por
eso también se le llamó licor de
Frobenius, aunque él lo denominó espiritus aetherus. Posteriormente sería llamado spíritus vini vitriolatus y éter
sulfúrico, hasta que Valentín Rose en 1800,
descubrió que no contenía azufre. La primera historia del éter la publica
Grosse a mediados del siglo XVIII. Newton también explica
que se obtenía a partir de óleo de vitriolo y espíritu del vino.
[21]
Faraday, establece que aquel
líquido volátil que hervía alrededor
de los 80ºC, tenía por composición C2H
(C=6), y lo nombra por su composición “bicarburet of hydrogen”. Sin embargo la primera referencia al benceno
la hace Glauber, en 1649, en su “Furni novi philosophici”,
cuando relata la destilación fraccionada del
alquitrán del carbón, usando después spiritus
salis fumans (HCl),
para su purificación, dice que se obtiene “un
agua ácida, que purificada no es inferior al óleo petri
en el calor que produce, con un olor agradable y delicado”. Estaba
describiendo sin saberlo al benceno. Mitscherlich(1833), en Berlín propone
el nombre de bencina y Liebig (1932), benzol.
Laurent, propondrá el nombre de fene, como origen del fenol, que no prevalecerá.
[22]
Fenol (llamado
así por Gerhardt), antes cyanol
(lo nombra así Runge
en 1834, ya que se obtenía al destilar el carbón, y producía color
violeta (cyano) con cloruro de calcio), también ácido carbólico (de carbon oil acid) y ácido fénico (Laurent
en 1842), deriva de phaino, “yo alumbro” en
griego, y tal como el castellano farol, procede del nombre de la isla de Pharo,
donde estaba el famoso faro de Alejandría. La unión linguística
entre fenol y benzol, hizo que el radical de éste se denominara fenilo y no bencilo.
[23] El nombre de química orgánica como texto (Organisk kemi) surgirá en la obra Djurkemi (química animal) escrita por el sueco Berzelius para sus alumnos de medicina, en 1806, con ella se designaba los proceso químicos que tienen lugar en los seres vivos, sin embargo este término ya aparece a finales del XVIII, en los escritos de Friedrich von Hardenberg, en el mismo sentido pero en otro contexto.
[24]
Véase en el “origen
del nombre del antimonio”, en la sección orígenes de esta web.
[25]
Éter porque ardía, y piroleñoso por que procedía
del fuego y la madera.
[26]
Explican esta
denominación, indicando que procede del griego :Xq, vino y Ù80 leña, madera:“cést à dire, vin ou
liqueur spiriteuse
de bois” (es decir vino o licor espirituoso de la madera).
Lo hacen en las investigaciones sobre radicales hidrocarbonados.
Precisamente en ellas se bautizó el radical orgánico más pequeño que llamaron
“méthylène” (Anales
de Química y Física, 1835). Para ellos el metil
era (CH)1, el etil (CH)2
y el butil (CH)4. En el mismo trabajo, establecieron
el concepto de función química.
[27]
Antes, en 1647,
Ángelo Sala, había publicado, que había extraído una sal de la oxalis (acedera), pero le dio el
nombre de tártaro: “Para hacer un
tártaro bien ácido es necesario exprimir el jugo de la oxalis
(rumex acetosa), aclararlo con blanco de huevo.
Después hay que filtrar el licor, evaporarlo, disolver el residuo con
agua hirviendo y abandonarlo a la cristalización”. Naturalmente lo
que había obtenido no era un tartrato sino un oxalato potásico.
[28]
En las Nuevas
Actas de la Sociedad de Stockolmo, de 1784,
aparece el trabajo “De ácido acetosellae”,
en el que Scheele. Para extraer este ácido dice :”Prefiero el acetato
de plomo a la cal porque el ácido vitriólico no desplaza del todo al ácido
oxálico que tiene una gran afinidad por la cal”.Cuando trató ácido
láctico con ácido nítrico, aparte del oxálico obtuvo otro ácido que llamó
“acidum sacchari lactis”, que después sería bautizado por Fourcroy como ácido múcico. También
obtendría ácido oxálico por oxidación del aceite dulce (glicerina) con
ácido nítrico.
[29]
Aunque su descubrimiento
se atribuye a Scheele, ya en 1777, había sido
aislado en Dijón, por Rouelle,
Macquer, Giennotti
y Monnet.
[30]
Hiarne, fue el químico europeo,
con mayor número de hijos. Tuvo 25 de los que 9 fueron varones, en tres
matrimonios.
[31]
Scheele, en una serie de trabajos
paralelos con magnesia nigra que le llevó al descubrimiento del manganeso y del oxígeno
(véase en la sección orígenes de esta web, “El
origen del nombre del manganeso”), trata el óxido de manganeso con ácido
sulfúrico y azúcar, obteniendo un
ácido parecido al vinagre pero mas fuerte, que identifica con el de las
hormigas. Sería el segundo compuesto orgánico sintetizado.
[32]
Agrícola, en
su tratado Re Metallica, de 1530, explica que
en las minas existen “animales pirogénicos”,
que nacen y viven en el fuego y son una especie de demonios, que matan
a los obreros de las minas, con un gas inflamable e irrespirable (hacía
referencia ya al metano).
[33]
Dalton había determinado las
fórmulas del gas de los pantanos y del gas oleificante,
haciendo explotar sus mezclas con oxígeno en un eudiómetro y analizando
la composición resultante.
[34]
Berzelius, en principio partió de asignar al oxígeno un peso atómico
de 100, refiriéndose a los demás elementos con relación a aquél. Después
tomó el H, C y O respectivamente como 1, 12 y 16; Liebig
(escuela alemana) como 1, 6 y 8 y Dumas (escuela francesa como 1, 6 y
18). Pero la influencia mayor fue motivada por que Beilstein,
al comenzar la enciclopedia de todos los compuestos orgánicos, basada
en la orgánica de Gmelín, adoptó el criterio alemán de Liebig.
[35]
Según esto, el
agua estaba formada por un átomo de hidrógeno y medio átomo de oxígeno.
[36]
El concepto de
equivalente, fue aplicado por primera vez por Cavendish
en 1766, para las diferentes masas de distintas bases que neutralizaban a una misma masa de un determinado
ácido. En apuntes de laboratorio de 1777, describe la preparación de soluciones
de sales con determinado peso equivalente. Wollaston
publica en 1814, en el Philosophical Transactions of the Royal Society “On a synoptic scala dof chemical
equivalents” y es la primera escala de pesos
equivalentes). Sus equivalentes son diferentes de los que publica Davy (H=1; O=7,5;Cl=32,5
etc) y Faraday, basados
en métodos electroquímicos. Se hacen sinónimos a pesos atómicos, por ello
la tabla de uso en Inglaterra en aquella época se titula:
”Table of Chemical Equivalents or Atomic Weights”.En
ella se usa al oxígeno como referencia dándole un valor de 10, y Dalton en 1808, había tomado como peso equivalente al peso
de un elemento que se combinaba
con el H tomado como unidad.
[37]
Gmelin, profesor de Heidelberg, es el autor del tratado de química mas extenso
del siglo XIX, el Handbuch der
Chemie, en 19 volúmenes (1948-1972), en él se
formula el agua, la potasa y el ácido nítrico como OH, KO y NO3
respectivamente, tal como hacía Dalton 50 años
antes. Había sido escrita con fórmulas de 4 volúmenes, y ejerció notable
influencia en la formación de todos los químicos europeos entre los 1850
y 70
[38]
El término radical
en el sentido químico actual fue usado por Guyton
de Mourveau en 1787. En los compuestos orgánicos
más sencillos estaba formado por carbono e hidrógeno (radical hidrocarburado).
Incluso los aceites se consideraban como compuestos sin oxígeno y eran
radicales libres. Sin embargo el primer radical aislado en 1815, por Gay-Lussac, solo tenía C y N, y se llamó cianógeno.
[39]
En 1817, Berzelius creía que todos los compuestos orgánicos eran óxidos
de radicales compuestos. Dumas, en 1837, juntamente con Liebig, publican en el Comptes Rendus una memoria en la que se dice: “La química orgánica presenta radicales que juegan el mismo papel que
los metales y metaloides. Se combinan entre ellos y con los cuerpos más
simples dando lugar a todas las combinaciones orgánicas. La química orgánica
se resume en la búsqueda de estos radicales y de sus propiedades”.
[40]
El sufijo ilo, característico de muchos radicales,
no parte de ningún químico, sino como ya se ha dicho, de un escritor
inglés, Coleridge, amigo de Davy
quien se lo sugirió en diciembre de 1808. Yl
o il, deriva del griego hyle,
materia o vida.
[41]
El radical otilo,
fue introducido por Williamson en 1852, denominándolo
así por la sustitución de 2H del etilo por un O; de oxígeno-etilo surgió
otilo.
[42]
Laurent y Gerhardt, van a crear la revista Comptes
Rendus des travaux chimiques, mas conocida como Comptes
Rendus, que nace como una revista de química heterodoxa y revolucionaria,
para las ideas que corrían en su tiempo, y que después se convertiría
en la revista de la sociedad química francesa.
[43]
Inicialmente
la idea de Dumas era que “En la
química orgánica existen ciertos tipos que persisten aún cuando en lugar
de hidrógeno contengan un volumen igual de cloro, bromo y yodo”. Existen
tipos químicos o sustancias con el mismo número de equivalentes unidos
del mismo modo y que poseen las mismas propiedades químicas fundamentales
y tipos mecánicos, sustancias que tienen fórmulas químicas similares producidas
por sustitución pero diferentes
en sus propiedades químicas”. Dumas diferenciaba el átomo físico (la
actual molécula) del átomo químico (átomo elemental).
[44]
Las aminas actuales
no se denominaban así, sino amidas. Nombre propuesto por Wurtz, debido a
que en su obtención se sustituía el hidrógeno del amoniaco por un radical
alkilo, procedente de un derivado halogenado (halide); de ammonia+ alkyl halide, salió amide.
El nombre de amina fue propuesto
mas tarde por Hofmann, que diferenciaría
las aminas primarias, secundarias y terciarias.