Fig.55
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Simbolismo Químico (continuación)
Desde
la alquimia al
siglo XIX
A finales del siglo XVIII, el panorama de la formulación y simbología química no podía ser más desolador.
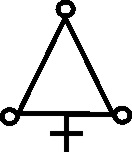
Como las nuevas sustancias necesitaban nuevos símbolos, que a su vez coincidían con los correspondientes a los antiguos nombres de las mismas sustancias, el lío en la documentación química era indescriptible. Científicos del mismo país, y contemporáneos empleaban diferentes símbolos para una misma sustancia, así por ejemplo, el profesor sueco Tobern Bergman, en 1770, siguiendo a Geofroy, emplea un símbolo aplicado al flogisto, al creerlo derivado del azufre (fig.55), como el de este elemento completado con un círculo en cada vértice del triángulo. Sin embargo Scheele, en 1777 en principio lo consideró aire vitriólico con el símbolo complejo (fig.56), y lo esquematizó con la letra F.

Fig.55
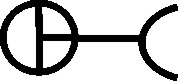
Fig.56
Las sustancias eran “bautizadas”, ya por su color, por su procedencia o por su descubridor. Por ejemplo, si un sólido era oscuro se le aplicaba el término etíope, así tenemos el etiope marcial que no era otra cosa que el actual óxido férrico; la interpretación del nombre, hacía referencia a un compuesto de hierro (marte) de color negro. Pero para el mismo compuesto también aparece otro nombre, por sus tintes rojizos: azafrán de marte [23] o zafre de marte, con su símbolo correspondiente (fig.57). También era muy conocido el azafrán de venus (óxido de cobre(II)), que tenía dos símbolos (fig.58 y 59).
El vitriolo marcial también llamado vitriolo verde (fig.60), por el mismo hecho será el actual sulfato de hierro(II) [24] , también el vitriolo azul (sulfato de cobre(II)) (fig.61 y 62) y el vitriolo blanco (sulfato de cinc) (fig.63 y 64), todos ellos con sus símbolos alquímicos. Como vemos por la simbología, predomina el aspecto metálico sobre el vitriólico, mientras que en otros se comparten.
Fig.57
Fig.58
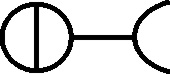
Fig.59

Fig.60
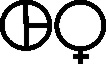
Fig.61
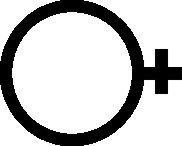 Fig.62
Fig.62

Fig.63
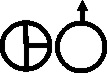
Fig.64
A comienzos del XVII, se conocía
el gas silvestre
[26]
, también llamado aire fijo y gas ventosum, porque
se producía en los eructos, que no era otra cosa que el dióxido de carbono,
que incluso se conoció como gas mefítico, diferenciándolo del gas pingüe, gas intestinal que era combustible.
Otras sales
tenían nombres en función de su apariencia, como las “mantecas”, que no eran
otra cosa que cloruros. Así, a mediados del siglo XVII, se conocía la manteca
de arsénico (AsCl3), la manteca de antimonio
[27]
(SbCl3), sin embargo el actual cloruro
de mercurio(II), era el sublimado corrosivo
[28]
, el cloruro de mercurio(I), era sublimado dulce
de mercurio, mercurius dulcis, o incluso aquila alba, mientras que el cloruro
de plata, era luna córnea
[29]
, por referencia a la plata
[30]
(fig.67). Sin embargo no es así cuando se describe
el nitrato de plata como lapis infernalis
[31]
, por sus características cáusticas. Si un compuesto
era volátil, sublimaba y luego cristalizaba, su nombre venía precedido del
de flores, así se conocían las flores del azufre, las de
antimonio, las de arsénico
[32]
, las de fósforo etc.
Algunas lo recibieron por el descubridor y el sitio en el que se descubrió, así por ejemplo se empleó mucho la sal de Epsom [33] , también conocida como sal amarga purgante, que no era otra cosa que sulfato de magnesio, y la sal mirábili de Glauber [34] , que corresponde al actual sulfato sódico. También Glauber dio nombre a la sal ammoniacum secretum de Glauber, que no era el sulfato amónico mientras que el cloruro de estaño era el licor fumante de Livabius. Sin embargo el sulfato potásico actual recibió diferentes nombres como tártaro vitriolado [35] , sal de duobus, arcano duplicado, piedra de la pupila y sal policréstica de Glaser [36] , mientras que el de cinc era vitriolo de Goslard o vitriolo blanco, como se ha visto. El ácido bórico actual era la sal sedativa de Homberg [37] (fig.68).
Quizá la sustancia
que más ha evolucionado en su nombre fue el nitro, cuyo nombre en forma de
natron fue dado por los egipcios
[38]
a un residuo salino que quedaba en las rocas y en
las piedras, cuando el agua dulce se desecaba. Con el tiempo sería el salitre,
o sal de piedra, que sería traducido por sal peter. Geofroy, en el XVII, distinguirá
el nitro de los antiguos (nitrato sódico), también llamado nitro de Chile,
del nitro de los modernos (nitrato potásico).
La antigua
denominación como natrón y su relación con el sodio, dio lugar a que el símbolo
actual de éste, lo recuerde.
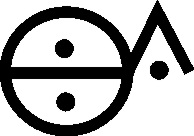
Fig.65
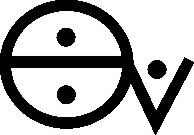
Fig.66
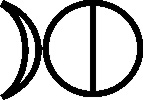
Fig.67
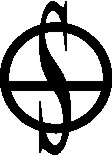 Fig.68
Fig.68
Sólo dos sustancias
han conservado su nombre durante los últimos 4000 años, la sal
[39]
(fig.69 y 70) y el amoniaco
[40]
(fig.71).
También determinados óxidos empleados
como colorantes, fueron conocidos en la antigüedad (descritos por Plinio en
su Historia Naturalis), como el litargirio
(fig.75) con una simbología extraña,
el minio, tetraóxido de plomo, el spodos, lana filosófica, nihil album o tutia
(óxido de cinc)
[45]
(fig.76), y ya en compuestos complejos, el alum (alam de los hebreos) o estripteria
de los griegos (alumbre).
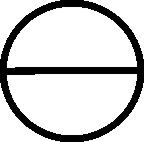
Fig.69
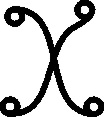
Fig.70
Fig.71
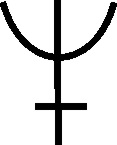
Fig.72

Fig.73
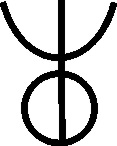
Fig.74
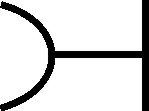
Fig.75
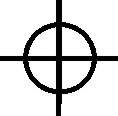
Fig.76
En el marco de los pigmentos eran
conocidos los sulfuros de arsénico, el rejalgar (fig.77) y el oropimente que con su coloración amarilla servían para la
trasmutación en oro y como no, el cinabrio (kinnabari) sulfuro de mercurio
(fig 78 - 81)
[46]
y el sulfuro de antimonio o stimmi de los egipcios
[47]
.
Mas tarde el espíritu ácido se
caracterizó por una cruz, y por lo tanto los ácidos derivados de sustancias
conocidas tuvieron unos símbolos dobles, como en el caso
del ácido de sal marina o ácido muriático (ácido clorhídrico) (fig.82), ácido
del nitro (ácido nítrico) también llamado aqua prima(fig.83),
ácido vitriólico o aceite de vitriolo o ácido universal (ácido sulfúrico)
[48]
(fig.84).

Fig.77

Fig.78
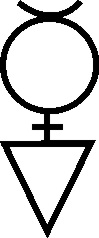 Fig.79
Fig.79
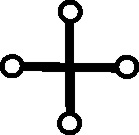
Fig.80
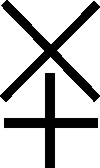
Fig.81
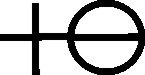
Fig.82
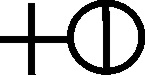 Fig.83
Fig.83
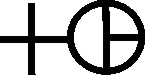
Fig.84
Algunos ácidos se usaron sin conocer
su composición y por eso no se asociaron los símbolos, así el agua fuerte
(ácido nítrico) (Fig.85) y el agua regia (fig.86) que disolvía el oro, que
contenían el símbolo del agua.
El record de nombres mas o menos peculiares, se daba a las combinaciones del vinagre (acetum), con distintas bases acidificables, así por ejemplo el actual acetato potásico se llegó a llamar por su aspecto o por su uso: tierra foliada de tártaro secretísima de Müller, arcano de tártaro de Basilio Valentin, magisterio purgativo de tártaro de Schroeder, tártaro regenerado de Tachenius y sal diurética de Sylvius.
Con el panorama descrito, no es de extrañar que a finales del siglo XVIII, los químicos franceses encabezados por Fourcroy, Lavoisier y Guyton de Mourveau, quisieran crear una nomenclatura sistemática basada en las combinaciones con el oxígeno. En este contexto, el Tratado Elemental de Química de Lavoisier marcó una época. Se definieron las convenciones de los nombres, según el estado de oxidación, el máximo con el sufijo ico, el mínimo oso (eux, en francés), y las sales respectivas atos e itos. La sales de no metales y metales, o sea las combinaciones no oxigenadas, uretos [49] . Estos sufijos proporcionarán los nombres de los compuestos químicos que han perdurado en la nomenclatura denominada tradicional.

Fig.85

Fig.86
Sin embargo Lavoisier tomó como simbología de las sus contemporáneos y discípulos Adet y Hassenfratz, que fijaron en 1787, unos rasgos para elementos y compuestos característicos:
No metales: El nitrógeno una barra horizontal (fig.87), el carbono con un semicírculo vertical (en forma de C)(fig.88), el hidrógeno un semicírculo vertical como C invertida (fig.89), el azufre el semicírculo abierto hacia arriba (fig.90), el fósforo abierto hacia abajo (fig.91) y el nitrógeno una barra inclinada(fig.92).
![]()
Fig.87
![]()
Fig.88
![]()
Fig.89
![]()
Fig.90
![]()
Fig.91

Fig.92
Metales: un círculo
con su inicial dentro: cobre (C) (fig.93), hierro (Fe) (fig.94), plomo (P)
(fig.95), estaño(S), (fig.96) y antimonio (Sb) (fig97) ( se consideraba como
un metal).

Fig.93

Fig.94

Fig.95

Fig.96

Fig.97
Ácidos: un cuadrado
con su inicial dentro: acético (A) (fig.98), muriático (M) (fig.99), vitriólico
(S) (fig.100).
Bases y óxidos
(tierras o cales): un triángulo con su inicial dentro: barita (Ba) (fig.101),
cal (C) (fig.102), magnesia(M) (fig.103), sosa (S)
(fig.104) y potasa (P), (fig.105) sustancias simples no descomponibles como
las consideraba Lavoisier.

Fig.98

Fig.99

Fig.100

Fig.101

Fig.102

Fig.103

Fig.104

Fig.105
En 1803, el inglés Dalton, como complemento a su teoría atomística, introduce una notación simbólica nueva, precursora de la actual formulación estructural. La simbología de Dalton era muy sencilla, cada átomo de un elemento era un círculo con la inicial del nombre del elemento en inglés. Para algunos elementos específicos la simbología se modificaba, como veremos.
Metalicos:
oro, plata, cobre, platino, hierro, cinc, plomo, estaño, níquel y mercurio
(fig 106 a 115)

Fig.106

Fig.107

Fig.108

Fig.109

Fig.110

Fig.111

Fig.112

Fig.113

Fig.114

Fig.115

Fig.116

Fig.117

Fig.118

Fig.119
Fig.120
Fig.121

Fig.122
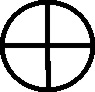
Fig.123

Fig.124

Fig.125

Fig.127

Fig.128
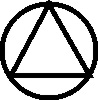
Fig.126

Fig.129
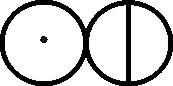
Fig.130

Fig.131

Fig.132
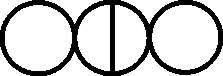
Fig.133
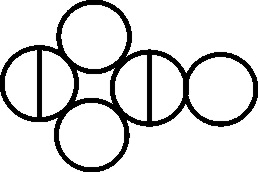
Fig.134
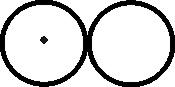
Fig.135
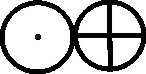
Fig.136
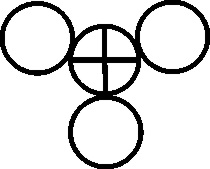
Fig.137
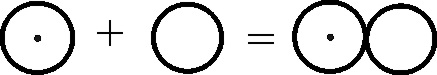
Fig.138
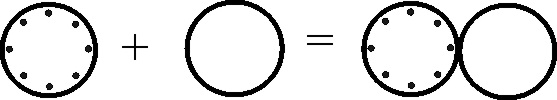
Fig.139
En 1810, en
un estudio sobre arseniatos y fosfatos, Dalton introduce por primera vez los
modelos espaciales en la formulación, empleando bloques y alfileres
[52]
.
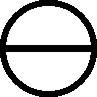
Fig.140

Fig.141

Fig.142

Fig.143

Fig.144

Fig.145
Fig.146
Fig.147
También se simbolizan, otras moléculas
diatómicas como las de CO, HCl
[55]
y NO (fig 148 a 150)

Fig.148
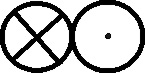
Fig.149

Fig.150

Fig.151
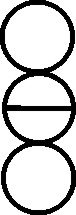
Fig.152

Fig.153

Fig.154
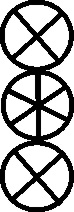
Fig.155
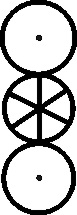
Fig.156

Fig.157
Fig.158
Gaudin será el primero en representar las reacciones de los
gases con esquemas simbólicos, así la reacción entre el cloro y el hidrógeno,
para formar ácido muriático. La formuló así:
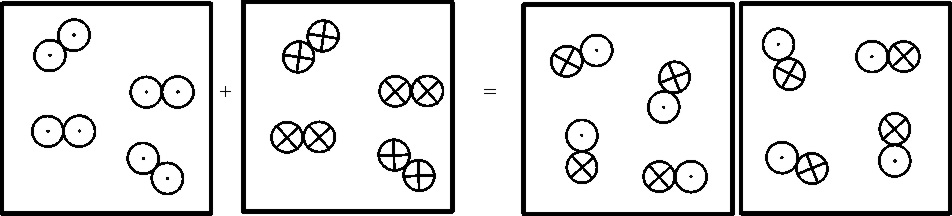
Entre ambos trabajos, surge la simbología de Berzelius, precursora
de la actual.
El químico
sueco Berzelius, en 1811, renueva la teoría dualística, que de otra manera
se había iniciado en la alquimia, contraponiéndola a la base experimental
que estaba surgiendo a través de la electroquímica impulsada por Davy
[57]
. Todos los compuestos estaban formados por una parte
positiva y otra negativa. Los ácidos (óxidos ácidos), por oxígeno y un radical,
produciendo, sustancias electronegativas. Las bases (óxidos básicos), por
un metal y oxígeno, dando lugar a sustancias electropositivas
y las sales neutras por un óxido ácido y
un óxido básico
[58]
. Estas ideas se plasman en un nuevo sistema de simbolismo
químico que desarrolla a partir de 1813. Primero sustituye las letras empleadas
por Dalton en los símbolos, por las iniciales del nombre latino del elemento
en cuestión
[59]
. Siguiendo el principio dualístico las fórmulas se escribieron
con el mecanismo de formación del compuesto, como en el caso del óxido de
aluminio, el óxido de calcio y el óxido de carbono (fig.159-161).
![]()
Fig.159
![]()
Fig.160
![]()
Fig.161
![]()
Fig.163

Fig.162

Fig.164
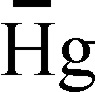
Fig.165
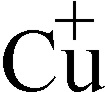
Fig.166
De esa forma algunos compuestos
más complejos como el actual permanganato
tendría la siguiente fórmula de Berzelius (fig. 167):
La necesidad de duplicar átomos diferentes de los simbolizados esquemáticamente, dio lugar a la introducción de una raya horizontal a un tercio de la altura del símbolo del elemento [60] . Este hecho motivó graves problemas tipográficos porque la dichosa raya podía modificar el propio símbolo, así el camaleón vegetal [61] (manganato potásico, K2MnO4), se representaba como indica la fig. 168.

Fig.167

Fig.168
Fig.169

Fig.170
La vuelta a todos los símbolos con sus iniciales, y los problemas tipográficos de las rayas, dio lugar a la necesidad de representar los átomos de oxígeno, introduciendo los números de relaciones atómicas, como superíndices, y así aparecen en muchos libros de textos de todo el siglo XIX. Sin embargo, Liebig y Poggendorf, convencieron en 1934 a Berzelius que bajara los superíndices a subíndices, con lo cual se creó la simbología actual, aunque en las reproduciones y textos españoles continuaron los superíndices durante muchos años.
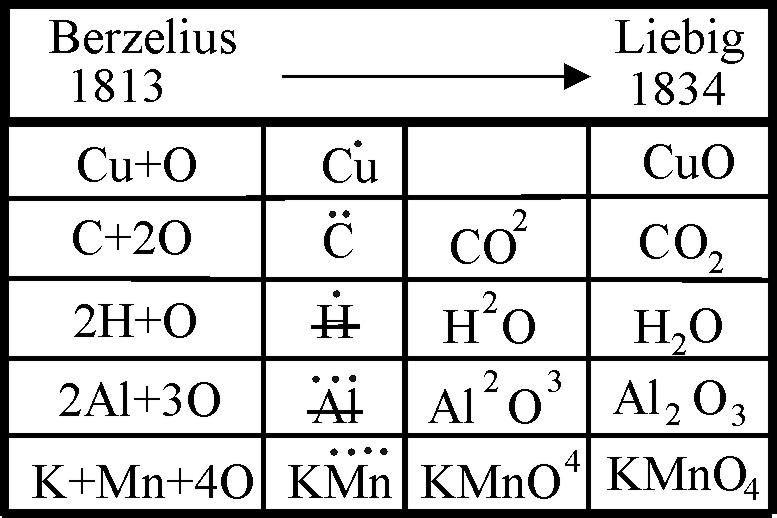
Sin embargo
aunque precursora de la actual, debido a los diferentes resultados experimentales
obtenidos (pesos atómicos, equivalentes químicos, etc), se modificó mucho
a lo largo del tiempo, por ejemplo, el óxido de plata, la sosa y la potasa,
no se formularon en 1824, como ahora las conocemos, sino,como se indica en
la tabla 1.

Berzelius
había conocido y estudiado dos ácidos del fósforo
[62]
, a uno lo llamó fosfórico y al otro metafosfórico,
que quiere decir el otro ácido del fósforo (meta quiere decir el otro). En
Inglaterra también estaba extendida la nomenclatura de Berzelius, así Graham,
en 1830, publica las fórmulas de los ácidos del fósforo: fosfórico, pirofosfórico
[63]
y metafosfórico, que evolucionarían tal como se
indica en el cuadro
[64]

Igualmente, las sales de sosa de los ácidos
fosfórico y metafosfórico tendrían esta fórmula, siguiendo la nomenclatura
inicial de Berzelius.

En 1846, Graham,
formulaba e interpretaba la reacciones de oxidación
del alcohol etílico para formar ácido acético y agua, tal como muestra la fig 171
![]()
Fig.171

Así mismo,
encuentra que el amoniaco en las sales aparece
como ion amonio con carga positiva (fig.172)
![]()
Fig.172
Los libros empleados por los estudiantes
de medicina y ciencias, en España,
durante 1850 y 1900, han empleado el sistema de cópula de Berzelius, con una
coma de separación entre las sustancias copuladas, así por ejemplo:
| sustancia |
fórmula |
sustancia |
fórmula |
sustancia |
fórmula |
sustancia |
fórmula |
| Sulfato
de amoniaco |
SO3,NH3,HO |
Sulfato
potásico |
SO3,KO |
Sulfato |
SO3,PbO |
Sulfato
|
3(SO3),Fe2O3 |
| Fosfato
sódico |
PhO5,2NaO,HO |
Fosfato
básico de calcio |
PhO5,3CaO |
Fosfato |
PhO5,CoO |
Fosfato
neutro |
PhO5,2CaO,HO |
| Hipoclorito |
ClO,NaO |
Hipoclorito |
ClO,CaO |
Ácido |
ClO7 |
Ácido |
ClO4 |
| Carbonato
|
CO2,MgO |
Carbonato |
CO2,PbO |
Carbonato
potásico |
CO2,KO |
Bicarbonato |
2(CO2),NaO |
| Cloruro |
Cl3Al2 |
Fluoruro
de |
Fl3Si |
Cloruro |
ClBa |
Fluoruro |
FlCa |
| Nitrato
potásico |
NO5,KO |
Nitrato |
NO5,PbO |
Nitrato |
NO5,BaO |
Nitrato
de |
NO5,NH3,HO |
| Hidrógeno |
C4H4 |
Ácido
|
PhO5,HO |
Ácido |
PhO5,3HO |
Ácido |
PhO5,2HO |
Como se puede comprobar, la formulación en 1846, no se parece
en nada a la actual, especialmente en los compuestos orgánicos como se verá.
A partir de mediados del siglo XIX, la simbología química, y la formulación de los diferentes compuestos, se desarrollará de la mano de los químicos orgánicos, considerándose la química inorgánica, como una extensión del propio sistema de formulación orgánica, por lo que se estudiará dentro de este contexto.
[23] El término azafrán se aplica a los sólidos con color rojizo, como el azafrán. El óxido férrico que se empleó como pigmento colorante, aparece como sadanu en los escritos sumerios
[24]
Ya enlos escritos
Rhazi (Liber Raxis, Lumen luminun, cuyo manuscrito está en la biblioteca
nacional de París) (900 d.C), aparecen como atramento y atramento verde.
[25]
Propuesto por Daniel Rutherford, descubridor
del nitrógeno. Derivan de Mefitis, deidad itálica, protectora contra los
vahos dañinos, muy abundantes en la zona por la actividad volcánica.
[26]
En aquella época
se conocían como espíritus o aires, puesto que el término gas se empleó
mas tarde, especialmente por los químicos
ingleses. La primera referencia a esta sustancia se hace por Cosmas de la
escuela de Alejandría, como “aire
sutil de los carbones”.
[27]
Todavía se empleaba
a principios del siglo XX, la manteca de antimonio, como cáustico.
[28]
En los textos
babilónicos aparece como sal de amanu
( nombre que procedía de Egipto).
[29]
Fue llamada
así por Oswald Croll en 1608, siendo usada por los alquimistas para trasmutar
el plomo en plata.
[30]
La plata también
se la mencionó como Diana ( por la diosa romana),
así cuando se obtenía a partir de una disolución de piedra infernal con cobre, formando precipitados
arborescentes, se le llamó árbol de Diana (Eck de Sulzbach, 1489).
[31]
Traducido del
latín sería piedra del infierno,
debido a que quema la piel, por eso se empleó para extirpar verrugas.
[32]
Las de arsénico
( As2O3) , también llamada
“nube de arsénico” ya eran empleadan
como depilatorio en Grecia.
[33]
Fue obtenida
por Nehemiah Grew, en 1695, del agua
de un manantial en el pueblo de Epsom.
[34]
Se la llamó así porque le había curado a Glauber
de un tifus (mal de Hungría), bebiendo agua del manantial de Neustadt, cerca
de Viena. Esta agua era conocida en el lugar como agua de salpeter.
[35]
Los tártaros, eran depósitos (precipitados)
que se producían en diferentes procesos químicos, inicialmente en la elaboración
del vino, y se llamaron así porque el que los consumía padecía “dolores
infernales” (tártaros = infierno en griego). Se dijo que producía gota.
[36]
Se empleó como medicamento antifebril,
pero servía para todo, de ahí su nombre (policréstica).
[37]
La obtuvo Homberg en 1702, a partir
del bórax término que procede de
los escritos del árabe Geber como baurag,
que a su vez lo hace del persa burah,
blanco) que procedía de un mineral del Tibet conocido como pounxa
o tinkal.
[38]
Aparece en el pueblo sumerio como
ne, después como ntr. El pueblo hebreo lo tradujo
por neter (así aparece en el Éxodo),
y de ahí pasó a nitro.
[39]
En las tablas
sumerias, aparece la sal como mun,
y la potasa como te-gaz, con el
mismo significado que el término actual. Según Partington, el símbolo de
la sal y otros antiguos proceden de la deformación de las letras griegas
que forman su nombre.
[40]
Recibe el nombre de un templo dedicado
a Amon-Ra, a donde acudían peregrinaciones en grandes caravanas. Con los excrementos de los
camellos que conducían se elaboró una especie de pegamento que fue el primer
“amoniaco”. Por su procedencia también fue llamado “espíritu de la orina”. Realmente lo que se obtenía era la sal
amoniaco (cloruro amónico), también llamado salmiac cuyo símbolo será antecedido por el de la sal marina. El último
símbolo expuesto coincidirá con otro símbolo atribuído a la magnesia.
[41]
El magnes (piedra imán),
nombre propuesto por Eurípides, fue llamado por error magnesia nigra (MnO2), por extraerse ambas de minerales
halladados cerca de la ciudad de Magnesia (actualmente Manissa) en Asia
Menor. La magnesia nigra se denomina así para diferenciarla de la magnesia alba (MgO). Después se llamaría braunstein (piedra oscura) y pirolusita,
porque se descomponía con el calor. Otros historiadores la derivan del griego 8bT(lavar), porque se empleó para limpiar el vidrio, de ahí
su otro nombre”jabón de los vidrieros”.
[42]
Deriva del árabe sawnad, aplicado a unas plantas marismeñas,
que formaban residuos negruzcos. En principio la sosa fue carbonato sódico.
La distinción entre el carbonato sódico y el potásico, fue hecha por primera
vez por Abu Mansur Monafig, en el
siglo X d.C.
[43]
El término potasa, deriva del alemán
pott (olla), y asche(ceniza), que era donde se
guardaban las cenizas de la planta kali, de donde se extraía.
[44]
En principio la potasa fue carbonato potásico,
denominado borith por el pueblo
hebreo (la “lejía de Jeremías”).
[45]
El término tutia, según Partington, deriva del persa dudha (humo), porque se obtiene de los humos que se forman al tostar
los minerales de cinc, con carbón.
[46]
Todos estos compuestos
ya fueron constatados por Plinio (siglo I d.C.), que confundió el minio
con el kinnabari, en su historia natural. Kinnabari, será el nombre griego del cinabrio (sulfuro de mercurio).
Los árabes lo llamaron zanjifar,
derivado del mercurio que era zaibaq
(ver el origen del nombre del mercurio, en la sección orígenes).
[47]
Su nombre generará el símbolo del antimonio (véase en
“El origen del nombre del antimonio”, en
esta web, en la sección orígenes.
[48]
Hasta en año 1670,
no se conoció la relación entre el
vitroleum y el azufre, por eso el símbolo de éste no aparecía.
[49]
Así se mantiene en portugués. Actualmente en francés es
ure, en español e italiano uro y
en inglés ide. El sufijo ico, en inglés, pierde la vocal final.
[50]
En aquel tiempo todavía no se
había aislado los metales que las forman, y eran consideradas sustancias
simples.
[51]
El agua se formulaba a principios del siglo XIX,
como HO, debido a los errores introducidos por el concepto de peso equivalente.
Fue Laurent el que en 1846, la formula como H2O, aunque Berzelius
lo anticipara.
[52]
Según Schorlemmer ( historiador
químico de finales del XIX), Dalton había empleado bloques cuadrados de
madera para representar los elementos químicos en las fórmulas (“The rise and development of organic chemistry”, London,1894).
[53]
El tramo vertical en el círculo
con Dalton, se convierte en horizontal con Gaudin.
[54]
Gaudin, desarrolla
gráficamente la teoría de Amedeo Avogadro de 1811, en la cual se postula
que las unidades fundamentales de los gases, son las moléculas que estaban formadas por dos átomos o posiblemente
un múltiplo de 2, en contra de lo que afirmaba Dalton. Aunque en muchos
textos se le atribuye a Avogadro el concepto de molécula, el que realmente lo creó
fue Gassendi que en 1630 tradujo
el término griego ÐZ6@4(onkoi) que significa una masa pequeña no perceptible
por los sentidos, por molécula derivada
del latin mole (masa grande o peso grande), derivado de la raíz indoeuropea
mo, hacer esfuerzo, de la que derivaría el término mol, propuesto por Ostwald,
en el sentido contrario, esto es; de algo muy grande. Así se puede leer
en Gassendi: “Los átomos forman primero
corpúsculos muy pequeños, pequeñas concreciones o moléculas las cuales posteriormente se agregan en cuerpos más grandes”.
Lo importante del trabajo de Gaudin, fue su carácter precursor, pues sólo
en 1846, se aclararían las estructuras de átomos y moléculas diatómicas.
Lo hace el francés Laurent: “ Cada molécula de un elemento puede dividirse al menos en dos partes que llamaremos
átomos. Dichas moléculas pueden dividirse solo en el caso de combinaciones.
Mi molécula representa la cantidad más pequeña de un cuerpo que debe usarse
para realizar una combinación, una cantidad que se divide en dos
en el acto de la combinación. De este modo el Cl puede formar parte de una
combinación pero para ello ha de utilizarse Cl2…”.
[55]
Ya se había descubierto que el gas muriático tenía H.
[56]
El hidrógeno sulfurado, llamado
hidrógeno sulfureto por Dalton (basándose
en la nomenclatura de Lavoisier), fue llamado antes por Scheele, gas hepático, y también era conocido por
gas hediondo del azufre.
[57]
Ambos científicos
se atacaban ferozmente en sus artículos, que rebatían continuamente. Aunque
la influencia de Berzelius en aquel tiempo era muy grande, pronto la escuela
electroquímica inglesa, continuada por Faraday y Daniell, le daría la razón
a Davy.
[58]
150 años antes,
Tachenius en el Hippocrates chemicus (Venecia 1666), explica: “ todo lo que es sal se descompone en dos sustancias:
un álcali y un ácido, así la sal amoniac se forma con espíritu de la sal
semejante al obtenido de la sal común y
álcali volátil idéntico al que se extrae de la orina”. O sea que ya
justificaba la neutralización y la hidrólisis.
[59]
No todos los símbolos coinciden
con los actuales, así Berzelius solía representar el potasio como Ka, derivado
del kalium, mientras que el símbolo del fósforo era P y Ph (del original
latino), el del cloro era Ch y no Cl, el del flúor, Fl y el del boro;
Bo.
[60]
Esta modificación de Berzelius,
provocaría una enorme confusión en la formulación química del siglo XIX,
ya que cada científico la interpretó a su manera, y lo que se originó como
un mecanismo de duplicidad, pasó a ser un sistema de formulación simbólica,
que se verá mas tarde, al que se acogerán diferentes escuelas científicas.
Así surgirá la formulación de dos volúmenes y la formulación de cuatro volúmenes
caracterizada precisamente por la barra debajo, basada en pesos
atómicos mitad de los actuales, característico de los químicos orgánicos
alemanes. Representará “ la cantidad de sustancia que ocupa en estado
gaseoso el mismo vlumen que cuatro volúmenes de hidrógeno”.
[61]
A mediados del siglo XVIII, lo llamó
así el químico y ceramista berlinés Pott, a la sustancia verdosa, obtenida
de la pirolusita, por los diferentes
colores que tomaban sus disoluciones acuosas.
[62]
Los ácidos del
fósforo se extraían de la orina y de los huesos, por eso eran conocidos
desde hace mucho tiempo. Parece ser que Boyle los conoció (“New Experiments and Observations made upon the Icy Noctiluca”, 1681-2),
aunque el ácido fosfórico está atestiguado por Scheele, al tratar huesos
con ácido nítrico, en 1774, aunque antes en colaboración con Gahn, se había
extraído de las cenizas de los huesos (1770).
[63]
El pirofosfórico,
se obtiene del fosfórico normal calentando, por eso se le denominó con el
prefijo griego pyros (fuego). Es completamente absurdo asociar los prefijos
meta, piro y orto (normal), a 1,
2 y 3 por 1, 2 y 3 moléculas de agua.
[64]
La raya debajo
del elemento indicaba en aquella época, la duplicidad del átomo anterior,
debido a la aplicación de los equivalentes con valores diferentes.
Otros sulfatos con nombres curiosos se verán más tarde.
De la misma forma
se conoce el etíope mineral que corresponderá
al óxido de mercurio(II), que también toma el nombre
de tierra foliada mercurial, por su
estructura. Los compuestos que al ser calentados producían gases no respirables,
eran mefitos
[25]
(los actuales carbonatos), así tenemos el mefito
de magnesia (actual carbonato de magnesio), mefito arcilloso (carbonato de
aluminio) etc.
Algunos carbonatos,
no fueron bautizados como mefitos sino
que tenían nombres específicos como sal álcali fijo (carbonato sódico) (fig.65)
y sal álcali volátil (carbonato amónico), también llamada “aceite de
tártaro per deliquium”(fig.66), con símbolos característicos.