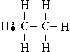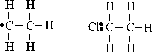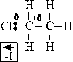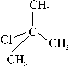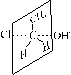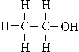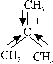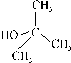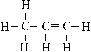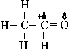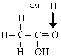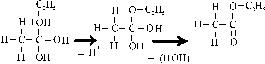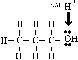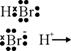REACCIONES ORGÁNICAS 2
|
TIPO |
REACTIVO |
SUSTRATO |
PASOS |
CARACTERÍSTICAS |
EJEMPLOS |
| SUSTITUCIÓN
RADICÁLICA
|
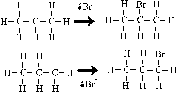
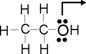
Se inicia por UV |
|
|
La sustitución se realiza sobre el hidrógeno con energía
de enlace menor. Primero el terciario, después secundario y por último
primario. Se sustituyen sucesivamente los H, sino se controla la reacción |
Halogenación de hidrocarburos, como paso para obtención
de otros productos. Formación de derivados polihalogenados, freones
y Sangre artificial |
|
NUCLEÓFILA BIMOLECULAR SN2 SUSTITUCIÓN NUCLEÓFILA UNIMOLECULAR SN1 |
OH- OH- |
|
|
Los efectos -I y +I, son fundamentales para determinar si la reacción es bimolecular
o unimolecular. En las primeras
se produce una inversión en la configuración (inversión de Walden) dado
que el reactivo nucleófilo se aproxima por la posición contraria a la
del Cl. La hibridación sp2 del C, dispone los lóbulos de los OA p en los sentidos del
OH- y Cl. Es importante para la obtención de alcoholes |
|
|
SUSTITUCIÓN
ELECTRÓFILA SE2 |
Cataliz H2SO4+ HNO3 = HSO4- + H2NO3+ NO2+ |
|
|
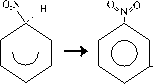
El reactivo electrófilo, se fija el carbono del benceno,
modificando su hibridación a sp3, rompiendo la aromaticidad
y formando un complejo sigma. La aromaticidad se recupera por eliminación
de un H+. También sustituye halógeno, alquilos, grupo sulfónico |
Da lugar a la obtención de derivados sustituidos del
benceno, muy impor-tantes para la obtención de colorantes (NO2+O=N-OH)
y detergen-tes(sulfónico, -SO3H) |
| ADICIÓN
ELECTRÓFILA AE2 |
|
|
|
El H se fija preferentemente donde hay más H (Regla
de Marckovnikoff, 1869), para que se forme el ion carbonio más estable.
Por eso se halogena preferentemente en C secundario (mayor rendimiento).
Si se quiere invertir (Efecto Kharasch), hay que introducir peróxido,
y la reacción sería radicálica. |
Adiciona H2, (los triples enlaces doble número
de moles), Cl2,Br2 decolora su color rojo), O3
(con ruptura de dobles enlaces y formación de aldehídos) |
| ADICIÓN NUCLEÓFILA AN2 |
|
|
|
Reaccionan las bases de Lewis CN- y OH-.Si
la reacción es lenta por el poco carácter + del C, hay que catalizarla
con H+, tal como en las de adición-eliminación |
La adición de CN- da lugar a cian-hidrinas,
que pueden producir amino ácidos y ácidos alcoholes. También adiciona
hidrógenosulfitos y OH- |
|
ADICIÓN ELIMINACIÓN AN2
- E |
|
|
|
Los ácidos se estabilizan por deslocalización con lo
cual el C no es suficientemente positivo, siendo necesario producir
iones carbonio, catalizándolo con H+. |
Se emplea para producir ésteres, y es una reacción reversible.
La inversa se denomina hidrólisis, empleándose catálisis básica , con lo cual se forman sales de ácidos orgánicos
(jabones). |
| ELIMINACIÓN E |
|
|
|
Para alcoholes se suele emplear un catalizador como
el H2SO4, formándose siempre el ion carbonio más
estable (mayor rendimiento),produciéndose más
alquilos (R.de Saytzew), por lo que el doble enlace se corre hacia el
centro. Para derivados halogenados, se emplea NaOH o KOH en disolución
alcohólica |
Se emplea para obtener dobles y triples enlaces, si
se halogena previamente. La reacción es reversible, y suele acompañar
a las sustituciones |