ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
SOLUBILIDAD 3
41. Una piscina de 25 x 5 x 2 m, completamente llena. Si está saturada con sulfuro de mercurio, el número de iones Hg2+ que habrá, será aproximadamente de:
a) 106 b) 10-6 c) 1016 d) 103
DATO:.KPs=4.10‑53. N.Avogadro=6,02.1023 iones/mol

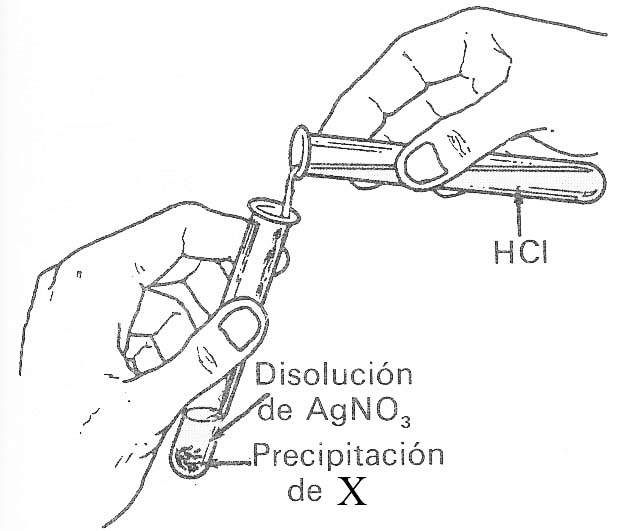
42. El dibujo muestra como se echa una disolución de ácido clorhídrico sobre otra de nitrato de plata, dando lugar a la formación del precipitado X. Naturalmente dirás que X es:
a) Nitrato de plata b)
Nitrato potásico
c) Cloruro de plata d)
Cloruro potásico
a) 0,09 b) 0,1
c)
0,01 d) 0,009
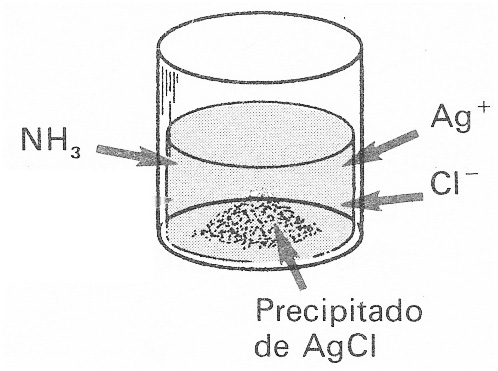
44*. El dibujo muestra como se ha formado un precipitado al agregar iones Ag+ y Cl-. Sin embargo si a este equilibrio heterogéneo se agrega una disolución de amoniaco, lo que ocurrirá es que:
a) Aumenta la sustancia precipitada
b) Se disuelve el precipitado
c) Se forma cloruro amónico
d) Se produce un complejo de Ag+ y NH3
45.El mercurio ese metal que aparecía en todas las casas, y que al romper un termómetro de los antiguos, formaba una bolitas que no había como cogerlas ni como limpiarlas, pues rápidamente escapaban del alcance de cualquier escoba, es un veneno muy peligroso. La máxima concentración permitida en el agua es de 0,5ppm , o sea 0,5 mg. por litro. Por ello la concentración de iones Hg2+ a la que comenzará a precipitar el hidróxido de mercurio(II) será mayor de:
a) 2,5.10-6M b) 2,5.10-5M c) 2,5.10-4M d) 2,5.10-3M
DATOS: KPs hidróxido mercúrico=1,2.10‑22.MASAS ATÓMICAS:Hg=200,6
59*. Pretendes hacer el experimento de la “Lluvia de oro”(fig.3), y para eso tomas una disolución de Pb(NO3)2 0,1M, y la mezclas lentamente con otra de KI 0,1M. Como observas en las figuras 1 y 2, la relación entre los volúmenes de la segunda y la primera es 2. Esto se debe a:
a) La estequiometría de la reacción
b) Se pone mas cantidad porque siempre se
pierden moles del segundo reactivo
c) Deberá haber el doble de moles de yoduro potásico
d) La densidad del nitrato de plomo es mayor
60. En la práctica anterior, tomas 100mL de Nitrato de plomo 0,1M, y 300mL de yoduro potásico 0,1M, echando lentamente una sobre la otra, al cabo de un tiempo apreciable, para que toda la lluvia de oro (PbI2), se deposite en el fondo del vaso o de la probeta. Se recoge el precipitado. Una vez filtrado y secado dicho precipitado, pesará aproximadamente en g:
a) 4,5 b) 10 c) 0,5 d) 1
DATOS: Kps PbI2=1,4.10-8
MASAS ATÓMICAS Pb=207,2; I=126,9

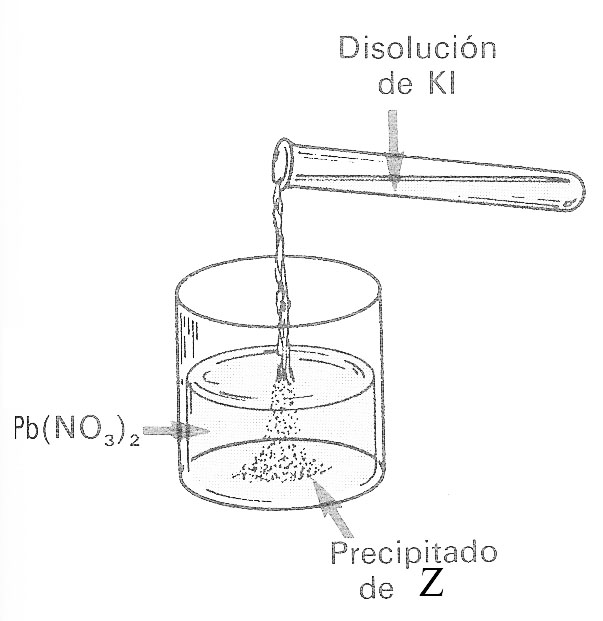
Fig.3
48. La concentración de ion bromuro en el agua del mar es de 0,07g/litro, mientras que la de ion cloruro es de 19g/litro. Si se agrega al agua de mar nitrato de plata:
a) Precipitará primero el AgBr b) Precipitará primero el AgCl c) No
precipitará ninguno
DATOS:KPs. AgCl=1,6.10‑10.
KPs.AgBr=7,7.10‑13. MASAS ATÓMICAS:Br=80/Cl=35,5.
49. A una disolución 3M de perclorato de rubidio, se le agrega otra de perclorato de litio, y por efecto del ion común la concentración de Rb+, se hace 111 veces mas pequeña. Con estos datos dirás que la constante de producto de solubilidad del perclorato de rubidio es:
a) 7,3.10-2 b)
2,9.10-2 c)
7,3.10-4 d)
2,9.10-4
50. La expresión de la normalidad de una disolución saturada de un compuesto de fórmula AB2 en función de su constante del producto de solubilidad , será:
a)
![]() b)
b)
![]() c)
c)
![]() d)
d)
![]()
51. Dos sales de fórmulas AB y A2C, tienen solubilidades molares S1 y S2, si sus constantes del producto de solubilidad son iguales, dirás que la relación entre S1 y S2 es:
a) 1 b)
![]() c)
c)
![]() d)
d)
![]()
52. Se pretende preparar una disolución saturada de sulfato de plata (Kps=1,7.10-5), en la que la concentración de ion plata sea igual a la del sulfato. Los gramos de sulfato sódico necesarios que habrá que disolver en 1 litro de disolución para conseguirlo será aproximadamente de:
a) 0,3 b) 0,03 c) 2,0 d) 1,8
DATOS: MASAS ATÓMICAS: S=32, O=16, Na=23
53. Se pretende preparar una disolución saturada de cromato de plata (Kps=1,1.10-12), en la que la concentración de cromato sea el doble de la del ion plata. Los gramos de cromato potásico necesarios que habrá que disolver en 1 litro de disolución para conseguirlo serán:
a) 2 b) 0,005 c) 0,02 d) 1
DATOS: MASAS ATÓMICAS: Cr=52, O=16, K=39
54. El saturnismo no es una enfermedad de futuros astronautas, ni tampoco hace referencia a un estado psíquico de estudiantes en períodos de exámenes. Es realmente un envenenamiento por plomo, puesto que por su carácter pesado se le relacionó con el planeta más lento del sistema solar; saturno. Debido a su antigua utilización en gasolinas etiladas para reforzar su octanaje, su ingestión se puede realizar sin darnos cuenta hasta por via respiratoria. De esta forma viviendo cerca de una carretera absorbemos por esta via mas de 0,05 mg. por día, de los cuales un 40% pasan a la sangre. Los iones Pb+2 se combinan con el azufre proteínico extrayéndolo de las estructuras en las que se encuentra, y formando sulfuro plumboso con KPs=1,0.10‑29.Teniendo en cuenta que tenemos aproximadamente 5 litros de sangre, el tiempo que se necesitaría para absorber la cantidad de plomo para que precipite en la sangre sería de:
a) Menos de un día b) Aproximadamente un mes
c) Cerca de un año d) Toda la vida
Masa atómica del plomo 207
55. La precipitación cuantitativa, suele considerarse cuando sólo el 0,1% de la concentración inicial de un ion permanece en la disolución. Según eso, el número de moles de yodato potásico que deberán añadirse a un litro de disolución 0,1M de yodato de bario, para la separación cuantitativa del ion Ba2+, será de:
a) 0,004 b) 0,2 c) 0,04 d) 0,02
DATO. KPs yodato de bario=1,5.10-9
56. Tienes un litro de disolución que contiene iones Ca2+ 0,02M y Ba2+ 0,02M, que pretendes separar cuantitativamente, para ello agregas sulfato sódico sólido. Los gramos necesarios para que se produzca dicha separación serán:
a) 0,1 b) 0,01 c) 0,001 d) 1
DATOS: Kps CaSO4 =10-5, KpsBaSO4=1,5.10-9. MASAS ATÓMICAS: S=32, O=16, Na=23
57. La concentración de ion cloruro en el agua del mar es de 19g/litro. El volumen de una disolución 0,02M de nitrato de plata que habrá que añadir a un litro de agua de mar, para iniciar la precipitación del cloruro de plata será en mL, aproximadamente de:
a) 1,5.10-3 b) 1,5.10-5 c) 1,5.10-8 d) 1,5.10-1
DATOS:KPs. cloruro de plata=1,6.10‑10. MASAS ATÓMICAS:Cl=35,5.
58. El acetato de plata, fue descrito por primera vez por Margraff, a mediados del siglo XVIII. Los gramos de acetato de plata que pueden disolverse en 1,26 litros de nitrato de plata 0,15M serán aproximadamente :
a) 3g b) 2g c) 1g d) 4g
DATOS: Su KPs.
es 2,3.10‑3. MASAS ATÓMICAS:C=12/Ag=107/O=16/

Fig.1
46. El dibujo muestra como se echa una disolución de yoduro potásico sobre otra de nitrato de plomo, dando lugar a la formación del precipitado Z. Naturalmente dirás que Z es:
a) Nitrato de potasio b)
Nitrato de plomo(II)
c) Yoduro potásico d) Yoduro de plomo(II)
47. La concentración de iones mercúricos en ppm (partes por millón) a la que comenzará a precipitar el Hg(OH)2, en las aguas de un rio cuya concentración de hidróxido es de 10‑6 M. será de:
a) 2,8.10-5 b) 2,8.10-11
c)
2,8.10-15 d)
2,8.10-8
DATOS: KPs hidróxido mercúrico=1,2.10‑22 MASAS ATÓMICAS: Hg=200,6/O=16/H=1.

Fig.2