ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
SOLUBILIDAD 1.
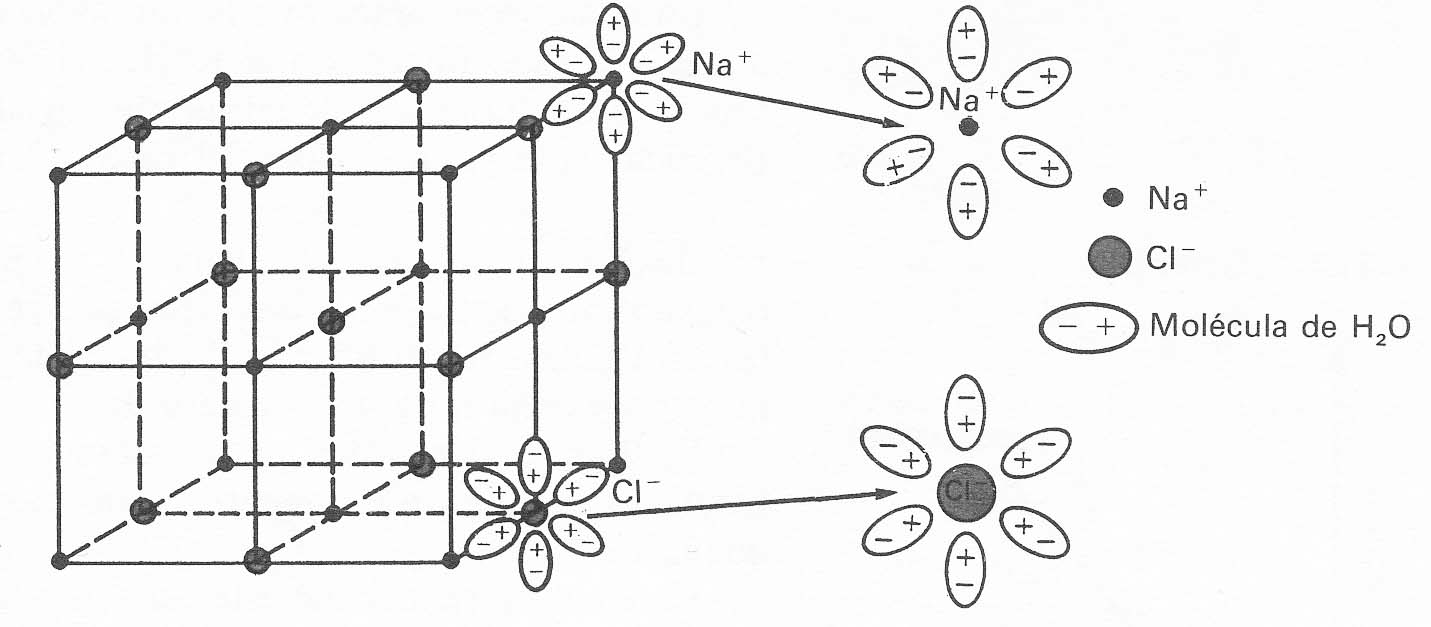
1*.El cloruro sódico, cuando se disuelve en el agua, sus iones
interaccionan con los dipolos del agua, como se observa en la figura.
Generalizando cuando una sal se disuelve
en el agua, deberá tenerse en cuenta su:
a) Energía de red
b)
Energía de hidratación
c) La temperatura del agua
d)
La cantidad de agua

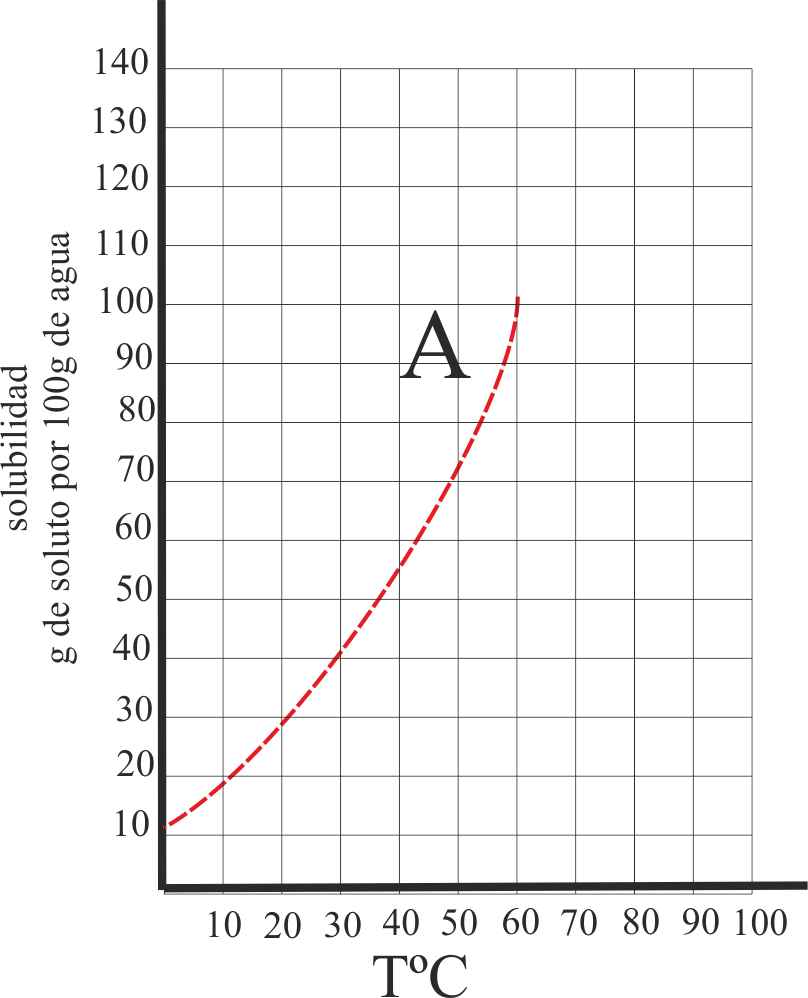
2*. La mayoría de las sales se disuelven fácilmente en el agua, pero en muchas de ellas, como el caso de la sustancia A, su solubilidad aumenta considerablemente con la temperatura, esto se debe a que:
a) Su estructura cristalina no es muy compacta
b) Tienen muy poca energía de red
c) Sus iones tienen una gran energía de hidratación
d) Son sustancias no cristalinas
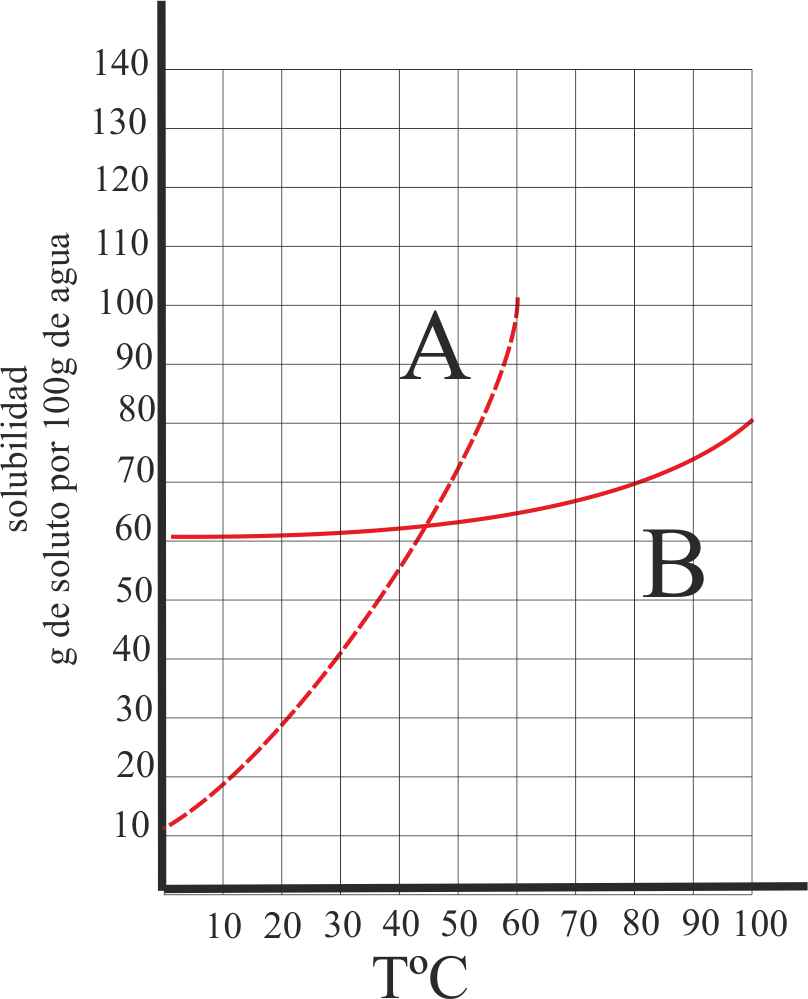
3*. Si tenemos dos sales A y B, cuya solubilidad varía con la temperatura como indica la figura, podrás decir de ellas que:
a) La A es mucho más soluble en
la caliente que la B
b) Si tenemos una disolución
saturada de ambas a 40ºC y enfriamos en el fondo del recipiente se separará prioritariamente
A
c) Será más fácil de cristalizar
A que B
d) Será más fácil preparar una
disolución sobresaturada con la B que con la A
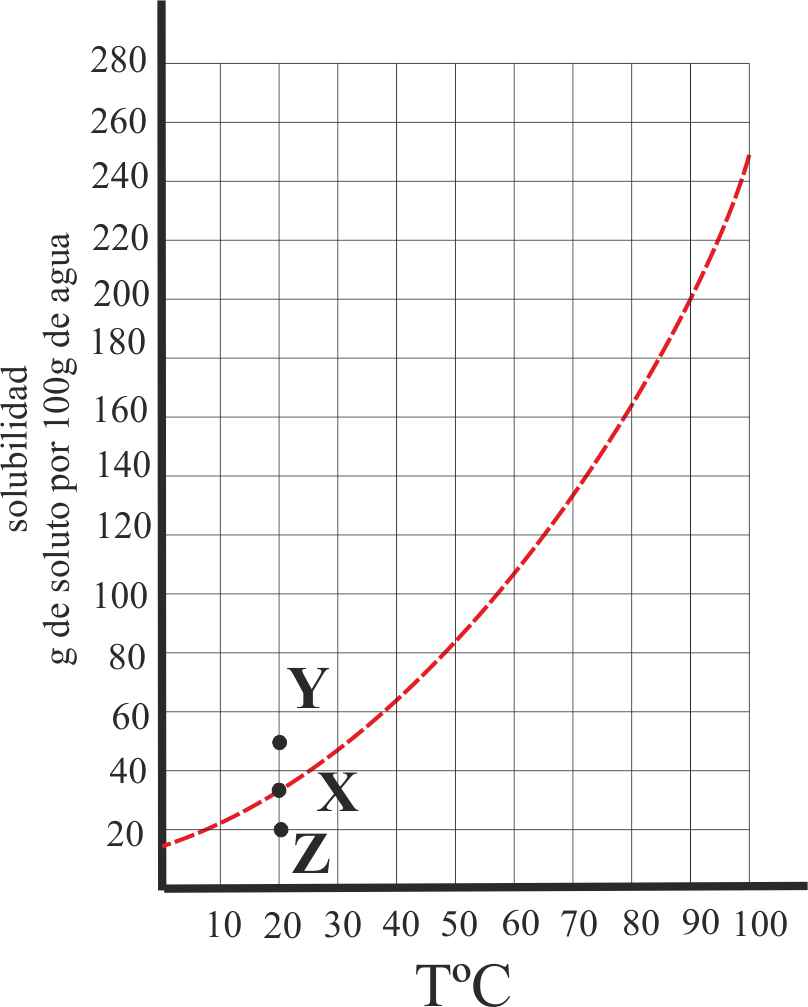
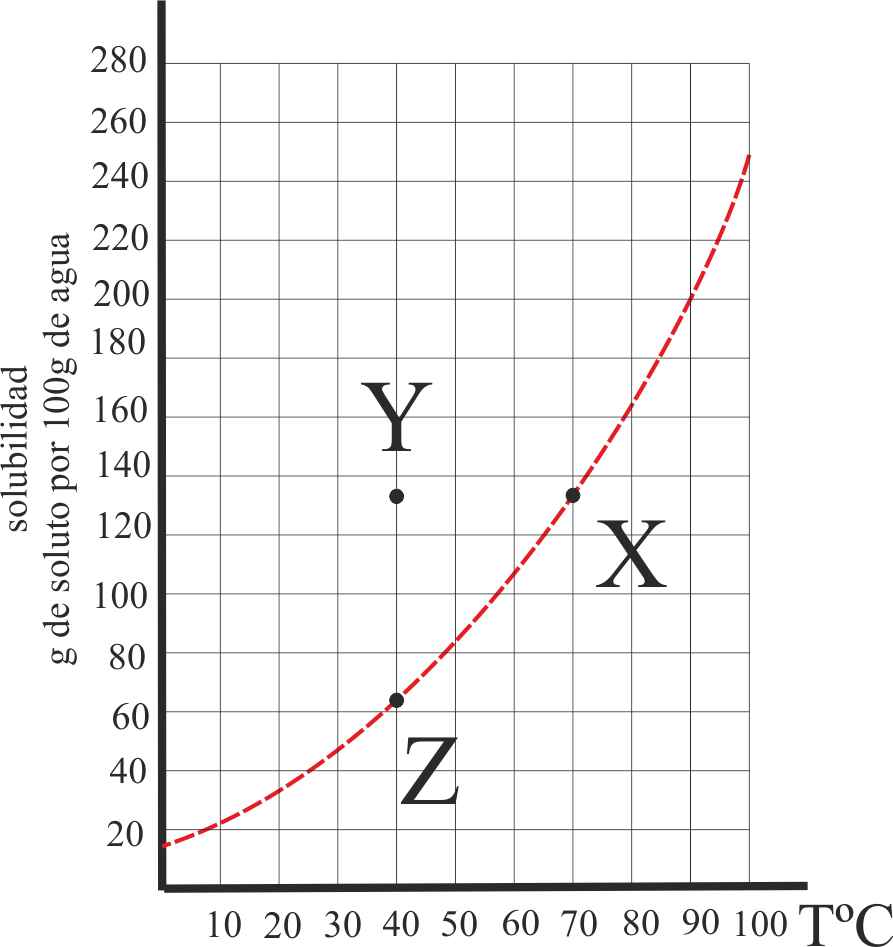
4. Dada la gráfica de la variación de la solubilidad de una sal, con la temperatura, en tres situaciones X, Y y Z, de ellas podrás asegurar que:
a) Y es una disolución saturada
de la misma
b) X es una disolución en
equilibrio entre fase sólida y fase disuelta
c) Z es una disolución que
admite más soluto
d) Y es una disolución sobresaturada
5*. Se prepara una disolución saturada X de una determinada sal, a 70ºC, con 138g de la misma en 100g de agua (véase la gráfica de la variación de la solubilidad con la temperatura). Después enfriamos hasta los 40º (posición Y), al cabo de un tiempo determinado la disolución alcanza el punto Z de la curva. De estos hechos podrás decir que:
a) Y es una disolución sobresaturada
b) Y es una disolución saturada
c) En Z, se producirá un precipitado de 78g de sal
d) En Z existe un equilibrio heterogéneo entre la sal disuelta y sin
disolver
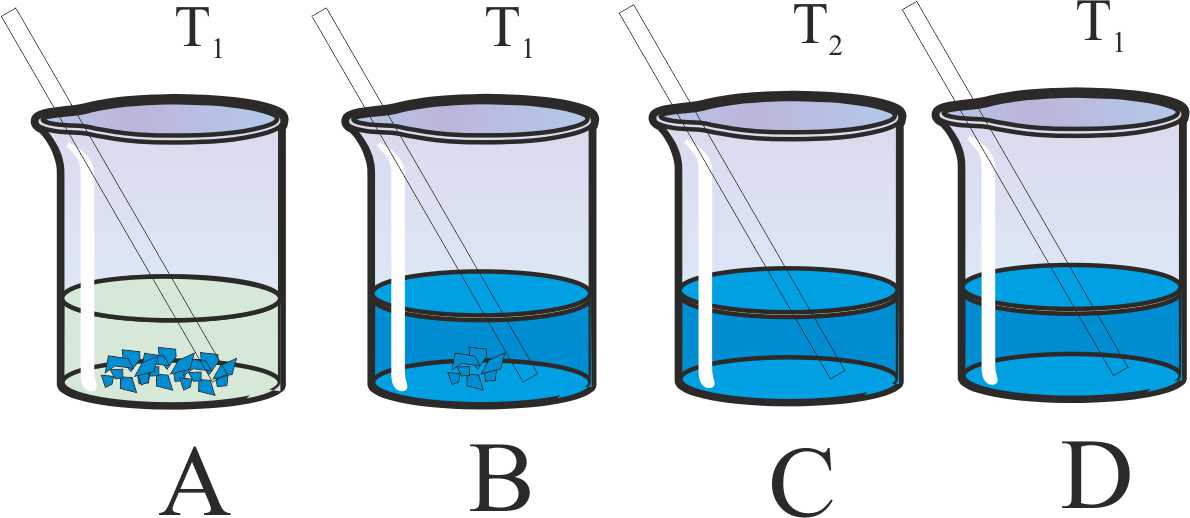
6*. Disuelves cierta cantidad de sulfato de cobre(II) pentahidratado (A).Agitas con la varilla y al cabo de un tiempo la situación se refleja en B. Calientas hasta T2>T1 (C), y después enfrías hasta T1. De todas estas situaciones dirás que:
a) B es una disolución no saturada
b) C es una disolución saturada
c) D es una disolución sobresaturada
d) Al cabo de cierto tiempo se producirá un precipitado en D
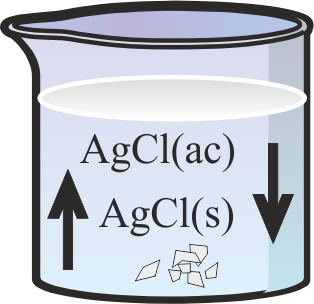
7. Se disuelve cloruro de plata en agua a 25º, hasta que se deposita en el fondo, tal como se observa en la figura. De esta situación dirás que:
a) Existe un equilibrio homogéneo entre la fase disuelta y la fase
sólida
b) Predomina la producción de un precipitado de cloruro de plata
c) Se produce un equilibrio heterogéneo entre la fase disuelta y
la fase sólida
d) El precipitado del fondo se disuelve preferentemente
8*. Cuando echas una sustancia sólida y poco soluble, como la cal, en un vaso de precipitados con agua, observas al cabo de cierto tiempo que en el fondo del recipiente queda sustancia sin disolver. En estas circunstancias podrás afirmar que:
a) La disolución está saturada
de hidróxido cálcico y su concentración en gramos/litro se denomina solubilidad
b) Existe un equilibrio
heterogéneo entre el hidróxido cálcico disuelto y el del fondo
c) Se produce un equilibrio
entre el oxido cálcico y el hidróxido cálcico
d) La velocidad con que se
disuelve el hidróxido es igual a la que le lleva a depositarse en el fondo
9*. Cuando se produce el equilibrio heterogéneo entre una sustancia disuelta y su estado disuelto, tratándose de electrolitos fuertes, lo que ocurre realmente es que:
a) Solo ocurre entre especies iónicas y la fase no disuelta situada en
el fondo del recipiente
b) Se sigue el principio de le Chatelier en
su desplazamiento
c) La constante de dicho equilibrio se denomina producto de solubilidad
d) La solubilidad dependerá solamente de la constante del equilibrio
10. La expresión de la constante del producto de solubilidad de una sal
de fórmula general AmBn, será:
a)
![]() b)
b)
![]() c)
c)
![]() d)
d)
![]()
11*. Los estudiantes de física y química, recuerdan a Walter Nernst, por haber enunciado el tercer principio de termodinámica, y por sus trabajos sobre pilas electroquímicas, sin embargo lo que no suele saberse es que fue un precursor de la música electrónica, al inventar un piano eléctrico. Definió el producto de solubilidad del que puedes decir que:
a) Es la constante del equilibrio heterogéneo en el que se encuentra
una disolución saturada
b) Es el producto de la concentración de los iones en una disolución
saturada de una sustancia
c) Siempre se mide en moles/litro
d) Sólo depende de la temperatura
12*. Cuando un hidróxido poco soluble, se disuelve en el agua dirás que su pH, dependerá de:
a) La solubilidad b)
La constante del producto de solubilidad
c) La temperatura d)
La cantidad de agua
13.El producto de solubilidad de un hidróxido poco soluble depende de
a)
La
solubilidad b)
pH
c) pOH d)
La temperatura
14*. El concepto químico de base, surge por ser estas sustancias la base de la formación de las sales, al combinarse con los radicales ácidos. Sin embargo este concepto ideado por Lavoisier, también abarcaba a numerosos óxidos, como la cal y la barita. Las bases o hidróxidos de los metales alcalinotérreos, son poco solubles, y su producto de solubilidad en disolución acuosa se puede calcular fácilmente si te dan:
a) La concentración de los iones metálicos
b) El pH de la disolución
c) La concentración de la fase sólida
d) La constante de equilibrio
15. Ya Basilio Valentino, "cronista químico", del siglo XV, escribía de una piedra que ayudaba a fundir a los minerales. Sin embargo será un médico de las minas bohemias de Joachimsthal, Jorge Bauer, más conocido por "Agrícola", el que describe en su tratado de minería "De re metálica", publicado en Basilea en 1530, este mineral que denomina: Lapis fluor (piedra que fluye). Este mineral que se llamó espato flúor, y después fluorita, tiene como base el fluoruro cálcico, y es el que dará nombre al flúor, que se extrae de aquel. Si el producto de solubilidad de CaF2 es 3.4.10-11, dirás que su solubilidad en g/litro será de:
a) 0,016 b) 2,04.10-4 c) 1,59.10-2 d) 2.10-2
Masas atómicas: F, 19 / Ca, 40
16. El carbonato bárico tiene un producto de solubilidad, a 25ºC, de 8.1.10-9, con este dato podrás decir que la normalidad de una disolución saturada de esta sal será de:
a) 8.10-7 b)1.8.10-4 c)4,5.10-5 d) 0.9.10-4
17. Preparas una disolución saturada de una sal AB, disolviendo 0.01 g. de la misma hasta obtener un litro de disolución, que a 27ºC presenta una presión osmótica de 3.74 torr. Con este dato podrás asegurar que el producto de solubilidad de la misma será aproximadamente:
a) 4.10-8 b)4.10-12 c)4.10-16 d)4.10-4
18*. Los productos de solubilidad de las sales de plata: 1. cromato de plata / 2. yoduro de plata / 3. cloruro de plata, son respectivamente: 4.10-12, 8.10-17 y 1.10-10. Con estos datos podrás asegurar que si en un volumen igual disuelves dichas sales hasta formar disoluciones saturadas:
a) Habrá más iones plata disueltos en la 1
b) La más insoluble es la 3
c) Si mezclas la 1 y la 2, se producirá un precipitado de yoduro de
plata
d) Si mezclas la 1 y la 2 se producirá un precipitado de cromato de plata
19*. Las aguas duras, son las que contienen una concentración en iones calcio o magnesio superiores en 60 partes por millón, y son las responsables de que los detergentes formen jabones insolubles, difíciles de arrastrar con agua, y que en las tuberías y lavadoras aparezcan costras sólidas que entorpecen su funcionamiento. Estas costras están formadas fundamentalmente por carbonato cálcico. Si su producto de solubilidad es de 1.7.10-8, podrás asegurar que para que se produzca, la concentración en iones calcio en moles/litro, tendrá que ser mayor que:
a) 0.00010 b)1.3.10-4 c)
0.00013 d) 0.0052
20. Muchos de los primeros ácidos encontrados procedían de extractos de plantas que recibirían nombres relacionados con las propiedades de aquellos, o sea el clásico picor en lengua. Así, existía una planta, llamada arumex acetosa, con estas características, recibiendo el nombre vulgar de acedera. De ella Wiegleb en 1770 extrajo un ácido que llamó, por todo lo dicho, oxálico (ox=ac).Su nombre sistemático será el etanodioico, precipitando fácilmente de sus sales, si existe el ion calcio, pues el producto de solubilidad del oxalato cálcico es 2,5.10-9. Con este dato, te será fácil pronosticar que la máxima cantidad de oxalato cálcico que puede existir en un litro de disolución, deberá ser de:
a) 64 g b) 5 mg c) 6,4 mg d) 0,5 mg
DATOS: C,12; O,16; Ca,40